
不畏浮云遮望眼,自缘身在最高层
免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICIs)彻底改变晚期肺癌乃至整个肿瘤治疗领域的格局。尽管PD-1/PD-L1抑制剂在某些癌种中达到40-70%的有效率(如黑色素瘤),临床研究数据表明在所有获批肿瘤中,有效率仅10-25%1。而在初始获益的患者人群中,更多人仍会不可避免地经历肿瘤的进展、复发,这成为阻碍癌症患者长期生存的难题。相较于分子靶向治疗,ICIs更容易受到肿瘤微环境的影响,因此具有更复杂的起效及耐药机制。因此,探讨免疫治疗耐药机制并针对性研发克服耐药的药物改造策略具有重大的临床意义。
免疫检查点抑制剂耐药类型及定义
目前免疫检查点抑制剂耐药模式分2类:原发耐药(Primary resistance)与获得性耐药(Acquired resistance)。原发耐药定义为第一次评估前或后PD或死亡,其主要原因是ICIs药物未能激活机体抗肿瘤免疫反应2。获得性耐药定义为初次接受免疫时CR或PR,随后又出现疾病进展或死亡。获得性耐药的主要原因是肿瘤细胞基于多种手段出现免疫逃逸,最终导致ICIs药物失效2。
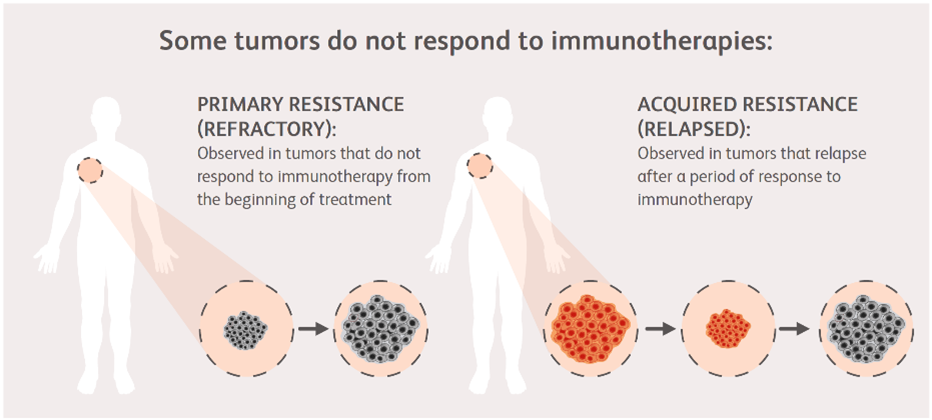
图 1 免疫检查点抑制剂耐药模式3
原发性免疫耐药机制
机体免疫系统成功发挥抗肿瘤免疫功能涉及诸多环节,主要包括肿瘤抗原的释放-呈递-加工,激活T细胞,趋化至肿瘤微环境,识别并发挥杀伤功能等。影响上述步骤的内在和外在因素都会导致免疫治疗耐药机制的产生。
一、肿瘤内在因素
1. 肿瘤抗原的缺乏或耐受
肿瘤抗原(包括肿瘤相关抗原与肿瘤新抗原)是T细胞识别并发挥杀伤功能的关键因素。肿瘤基因突变引起DNA编码位点改变,形成大量肿瘤新抗原。肿瘤新抗原负荷,包括肿瘤突变负荷是免疫治疗疗效的强效预测因子,但许多肿瘤细胞表面新抗原缺失,或者新抗原免疫原性差,难以激活有效的T细胞免疫反应。这是肿瘤细胞对免疫治疗天然抵抗的最直接原因4。
2. 肿瘤抗原加工与呈递功能障碍
肿瘤抗原通过内源性抗原呈递途径,经MHC I类分子呈递到细胞表面,被T细胞TCR受体识别,发挥抗肿瘤效应。但当抗原呈递障碍时,T细胞同样无法识别肿瘤细胞,从而产生耐药5。
3. 肿瘤细胞异常表达基因及通路
肿瘤细胞由于累及大量的基因突变,较其他正常组织细胞存在不同的基因及信号通路表达规律。而某些异常表达的信号通路可阻碍免疫细胞的浸润、识别及效应功能,进而形成免疫抑制性微环境,从而抵抗免疫检查点抑制剂疗效。例如IFN-γ response、Wnt/β-catenin信号通路等6。
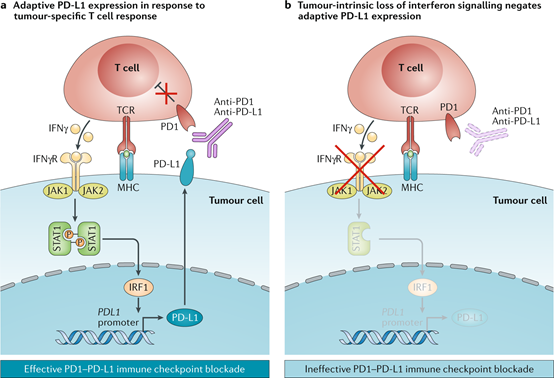
图 2 IFN-γ response信号通路与免疫检查点抑制剂耐药4
二、肿瘤外在因素
与传统化放疗不同,ICIs起效需依赖与肿瘤细胞关系密切的肿瘤免疫微环境(Tumor microenvironment, TME),TME包括调节性T细胞(Tregs)、髓系来源免疫抑制细胞(MDSCs)、肿瘤相关巨噬细胞(TAM)及肿瘤间质细胞、成纤维细胞等。这些细胞在免疫治疗耐药过程中均发挥着重要影响作用。
1. 调节性T细胞
Tregs在肿瘤微环境和外周循环中均大量存在,其通过分泌抑制性细胞因子IL-10、IL-35及TGF-β等抑制效应T细胞的反应。抗CTLA-4和抗PD-1抗体可以使肿瘤浸润Tregs大量减少并增加了肿瘤微环境中效应T细胞Teff与Treg的比率7。然而,但Tregs代偿性增殖及Tregs 上其它检查点分子的表达上调使得Treg仍然是驱动ICIs耐药的重要机制之一。
2. 髓系来源免疫抑制细胞
MDSCs是肿瘤微环境中具有免疫抑制活性的另一类免疫细胞亚群。MDSCs通过不同的介质,如精氨酸酶1、诱导型一氧化氮合酶(iNOS)等来减弱效应T细胞和NK细胞的活性,调控Tregs的分化,并在巨噬细胞中诱导免疫抑制表型。具有促进血管生成、免疫逃逸和转移的作用8。研究表明肿瘤微环境中的MDSCs浸润与免疫治疗疗效成负相关,提示其可能是免疫治疗原发耐药的重要原因之一8。
3.肿瘤相关巨噬细胞
肿瘤相关巨噬细胞在肿瘤免疫调节中也起着关键作用。TAM包括M1型促炎型与M2抑炎型。两者具有高度的可塑性。M1型巨噬细胞表达促炎症细胞因子并促进抗肿瘤免疫反应,而M2型巨噬细胞的特点是表达抗炎性细胞因子和趋化因子,抑制CD8+T细胞活化,促进Tregs的募集,并有助于肿瘤免疫逃逸2。在肿瘤微环境中大量存在的M1型巨噬细胞可能是ICIs耐药的原因之一,通过强效抑制T细胞功能甚至捕获PD-1/PD-L1抗体导致免疫治疗耐药9。
4.肿瘤相关成纤维细胞
肿瘤基质细胞中存在很大比例的细胞为肿瘤相关成纤维细胞(CAFs)。CAFs在ICIs耐药中扮演重要作用。一方面,CAFs通过分泌各种细胞因子与其他基质细胞、肿瘤细胞进行信息交流,抑制免疫细胞功能,促进肿瘤发展,例如通过IL-6、TGF-β抑制DCs的抗原呈递功能。另一方面,CAFs 还具有塑造肿瘤外基质、形成药物或治疗性免疫细胞渗透屏障作用,阻止药物与免疫细胞向肿瘤组织的深层渗透,从而降低肿瘤治疗效果10。
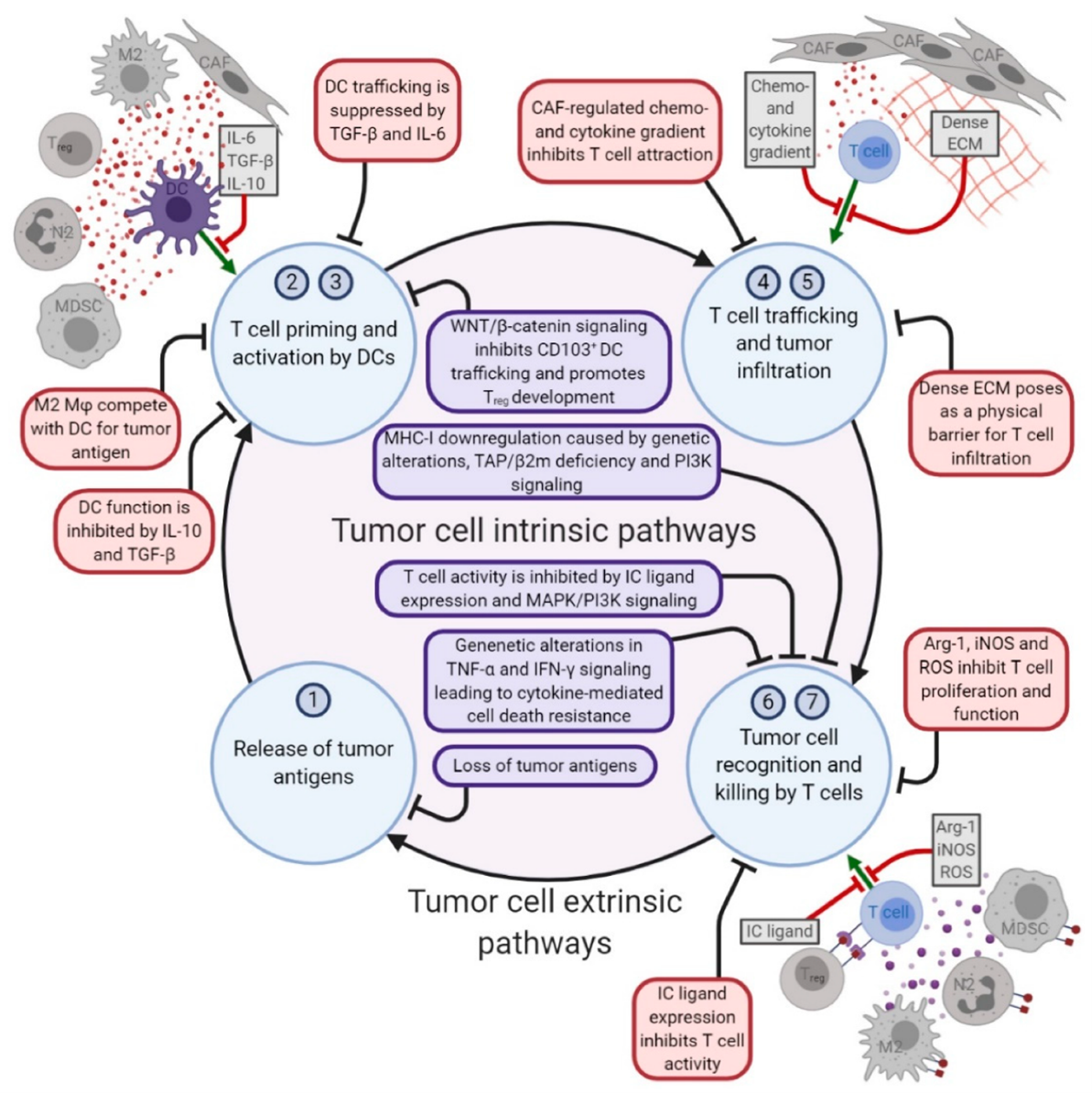
图 3 免疫治疗原发耐药机制11
获得性免疫耐药机制
与原发性耐药研究不同,获得性耐药的机制探索尚不明晰。除原发耐药的相关机制可能同样在免疫治疗起效后继发出现外(如肿瘤基因突变等),主流观点仍认为肿瘤的进化选择作用(即免疫治疗耐药亚群经过获得性筛选后增殖扩增)可能是获得性耐药的主要内源性因素12。目前研究的内在获得性耐药机制包括免疫信号通路基因突变、肿瘤抗原免疫编辑及其他免疫检查点抑制出现等。研究报道,出现获得性耐药会有其他T细胞检查点蛋白表达上调,包括TIM3、LAG3、VISTA等2。
近年来针对药物代谢及稳定性的外源性耐药机制的研究逐渐进入人们的视野,作为一类外源性抗体药物,抗PD-1/PD-L1抗体序列自身可能具有免疫原性,进而诱导机体中和性药物抗体(Anti-drug antibody, ADA)的合成而清除抗PD-1/PD-L1抗体,影响药物代谢进而影响免疫治疗疗效。是免疫治疗获得性耐药的重要机制之一。在针对5款国外ICI药物(ipilimumab, nivolumab, pembrolizumab, atezolizumab, durvalumab, avelumab)的抗药抗体检测中,抗PD-L1单抗的患者ADA检出率高达54.1%(EMA数据)13。基于临床试验的探索性分析数据表明,ADA阳性患者药物清除率更高,似乎较阴性患者拥有更差的预后13。因此针对PD-1/PD-L1靶点开发人源化程度更高的单克隆抗体或许具有更好的临床效果与治疗疗效。舒格利单抗作为全人源化IgG4,免疫原性低,不易产生ADA,在药物代谢及稳定性上或优于其他PD-1/PD-L1单克隆抗体。
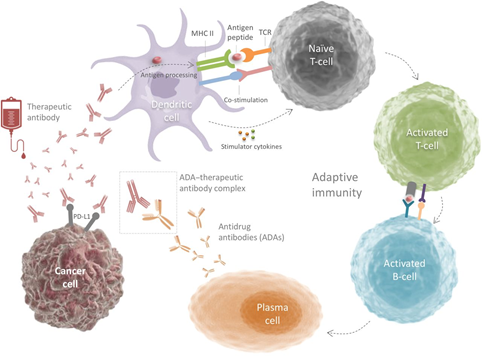
图 4 PD-1/PD-L1抑制剂抗药抗体的产生13
总结
ICIs耐药是制约免疫治疗应用的最大瓶颈,因此深入探究免疫治疗的耐药机制,对未来进一步提高恶性肿瘤治疗现状具有重要的临床意义。期待未来研究能开发出新的免疫治疗药物或新的免疫治疗联合策略,突破免疫治疗耐药的瓶颈,在恶性肿瘤领域取得新的突破。
参考文献:
-
1. Bagchi S, Yuan R, Engleman EG. Immune Checkpoint Inhibitors for the Treatment of Cancer: Clinical Impact and Mechanisms of Response and Resistance. Annu Rev Pathol 2021; 16: 223-49.
2. Sharma P, Hu-Lieskovan S, Wargo JA, Ribas A. Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy. Cell 2017; 168(4): 707-23.
3. Understanding I-O Resistance. 2022. https://www.bms.com/media/media-library/scientific-media-resources/io-resistance.html.
4. Kalbasi A, Ribas A. Tumour-intrinsic resistance to immune checkpoint blockade. Nat Rev Immunol 2020; 20(1): 25-39.
5. Gettinger S, Choi J, Hastings K, et al. Impaired HLA Class I Antigen Processing and Presentation as a Mechanism of Acquired Resistance to Immune Checkpoint Inhibitors in Lung Cancer. Cancer Discov 2017; 7(12): 1420-35.
6. Shin DS, Zaretsky JM, Escuin-Ordinas H, et al. Primary Resistance to PD-1 Blockade Mediated by JAK1/2 Mutations. Cancer Discov 2017; 7(2): 188-201.
7. Hamid O, Schmidt H, Nissan A, et al. A prospective phase II trial exploring the association between tumor microenvironment biomarkers and clinical activity of ipilimumab in advanced melanoma. J Transl Med 2011; 9: 204.
8. Law AMK, Valdes-Mora F, Gallego-Ortega D. Myeloid-Derived Suppressor Cells as a Therapeutic Target for Cancer. Cells 2020; 9(3).
9. Xiang X, Wang J, Lu D, Xu X. Targeting tumor-associated macrophages to synergize tumor immunotherapy. Signal Transduct Target Ther 2021; 6(1): 75.
10. Hanley CJ, Thomas GJ. Targeting cancer associated fibroblasts to enhance immunotherapy: emerging strategies and future perspectives. Oncotarget 2021; 12(14): 1427-33.
11. van Elsas MJ, van Hall T, van der Burg SH. Future Challenges in Cancer Resistance to Immunotherapy. Cancers (Basel) 2020; 12(4).
12. Li J, Stanger BZ. How Tumor Cell Dedifferentiation Drives Immune Evasion and Resistance to Immunotherapy. Cancer Res 2020; 80(19): 4037-41.
13. Enrico D, Paci A, Chaput N, Karamouza E, Besse B. Antidrug Antibodies Against Immune Checkpoint Blockers: Impairment of Drug Efficacy or Indication of Immune Activation? Clin Cancer Res 2020; 26(4): 787-92.
相关阅读
【肺Talks】ROS1半月谈(三)ROS1融合阳性NSCLC患者的治疗
【肺Talks】ROS1半月谈(四)关于肺癌EGFR 19del和21L858R突变,我们需要知道的事!
【肺Talks】ROS1 半月谈(五)-ROS1 TKIs耐药
【肺Talks】免疫治疗半月谈(三)-- 非小细胞肺癌免疫治疗生物标志物应用现状
【肺Talks】免疫治疗半月谈(四)-- 非鳞NSCLC的免疫抑制剂治疗
【肺Talks】免疫治疗半月谈(五)-- 肺鳞癌的免疫抑制剂治疗



