
乳腺癌是导致全球范围女性因恶性肿瘤死亡的主要原因,此患者群体中约有70%表现为雌激素受体(ER)和孕激素受体(PR)阳性,以及人表皮生长因子受体(HER2)阴性。内分泌治疗(ET)是此类患者系统治疗的主要手段,但在临床实践中,患者可能因原发性及获得性内分泌抵抗而导致ET应用受限,尽管联合细胞周期依赖性激酶4/6抑制剂(CDK4/6i)有助于克服内分泌抵抗,但这又可使患者对CDK4/6i的耐药。选择性雌激素受体降解剂(SERD)作为一种具有克服内分泌抵抗的ET药物,具有广阔的临床应用前景,目前已有多项乳腺癌领域SERD相关研究完成或正在进行中1。为此,本文总结口服SERD类药物的作用机制,并回顾其在乳腺癌中的应用情况,以期为临床医生提供参考。
SERD类药物作用机制及目前乳腺癌治疗相关研究中的口服SERD的药物
乳腺癌肿瘤的发生发展与雌激素-ER间的作用相关。雌激素可通过结合ER激活下游信号转导,促进肿瘤的生长与增殖,而ET可阻断这一路径发挥治疗作用。SERD属ET类药物,其机制为“降解雌激素受体的α亚基(ERα)”。2002年,首个SERD 类药物氟维司群上市,它可通过结合ERα引起后者结构变化,增加ERα表面疏水性,从而吸引E3泛素连接酶和蛋白酶体而诱导ERα降解,至此雌激素失去作用靶点,达到控制肿瘤生长增殖的目的2。
目前,除氟维司群外,Elacestrant、Camizestrant、Giredestrant、Imlunesterant、Amcenestrant在内等多种口服SERD已应用于乳腺癌相关研究,在转移性/晚期乳腺癌,乳腺癌术前治疗及辅助治疗场景中取得了一定成果。此外,对于获得性耐药(主要由编码雌激素受体相关基因ESR1突变引起)患者,研究显示口服SERD治疗也有积极作用。目前,更多的研究处于在研状态(见附表1、2)1。
1. Elacestrant在ER+乳腺癌中的应用
1) 转移性/晚期乳腺癌治疗
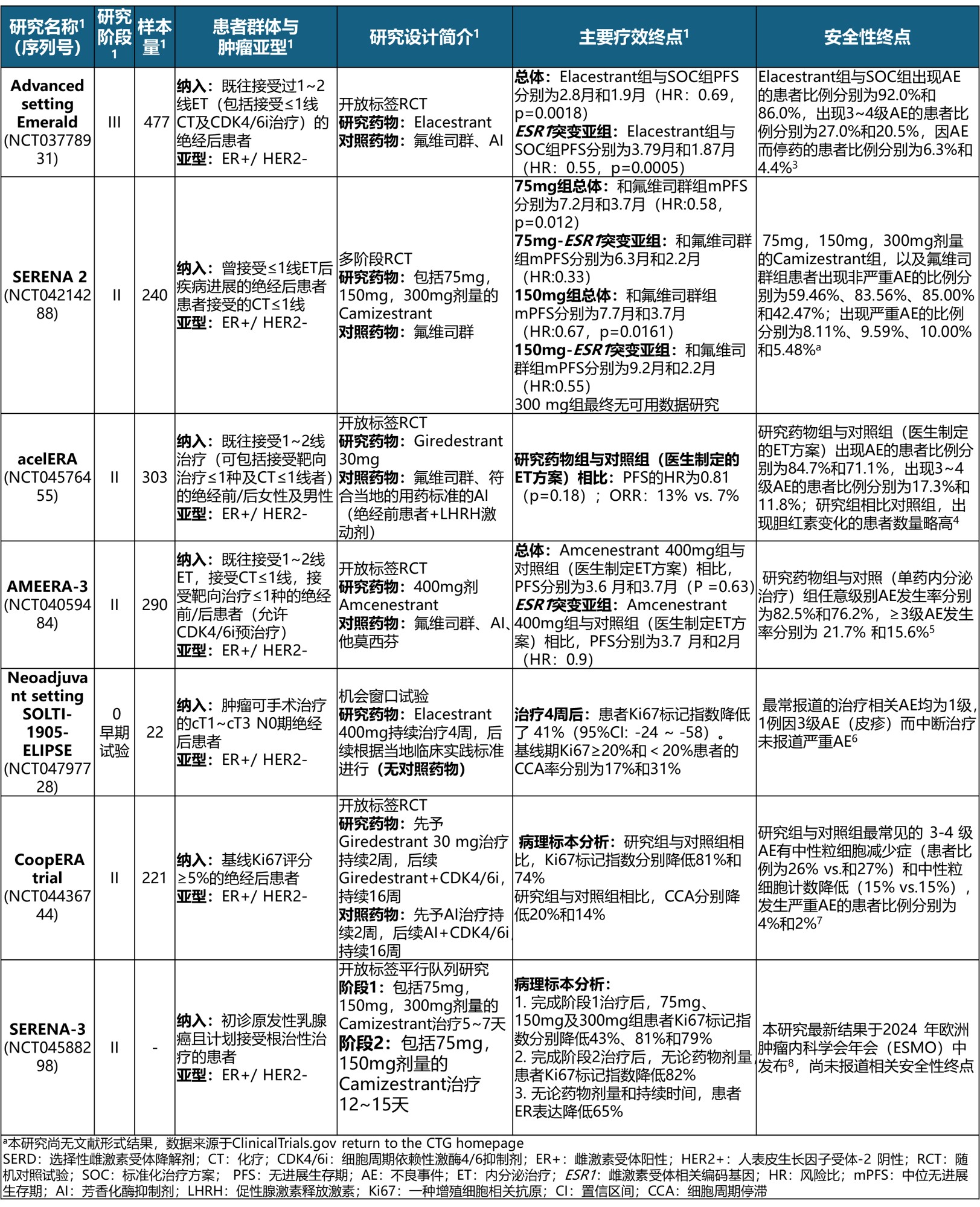
EMERALD研究纳入既往接受1~2线ET,包括≤1线化疗(CT)及CDK4/6i治疗的绝经后ER+/ HER2-乳腺癌患者477例,评估Elacestrant与对照组(氟维司群等)间疗效和安全性差异。结果显示在总体或ESR1突变亚组分析中,Elacestrant组相比对照组患者无进展生存期(PFS)均显著提高(表1)1。
表1 口服SERD类药物相关II期及III期试验结果(已完成的研究)
2) 乳腺癌术前治疗和辅助治疗
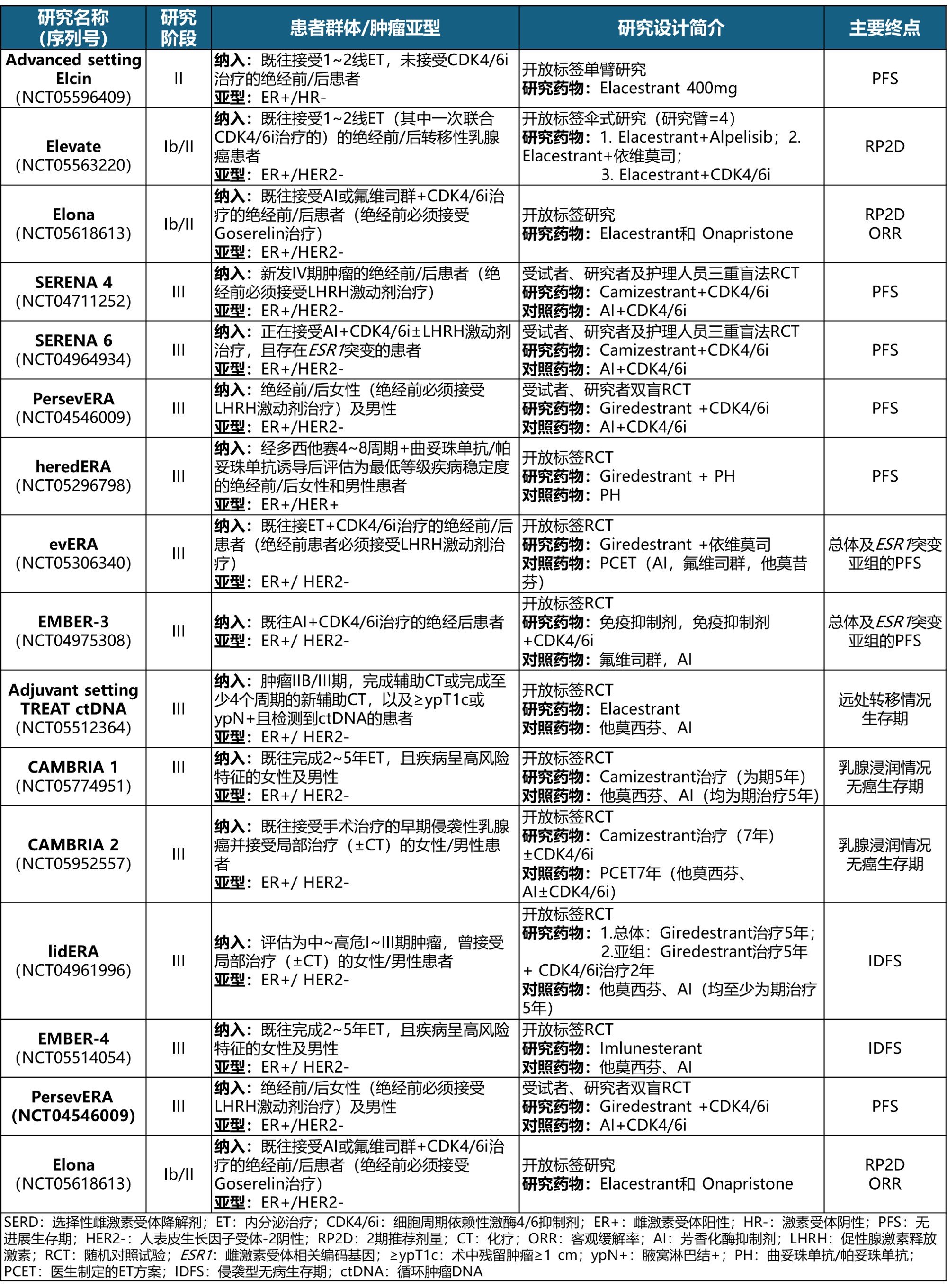
SOLTI-1905-ELIPSE研究纳入可手术治疗的cT1~cT3 N0期,ER+/ HER2-绝经后乳腺癌患者。结果显示Elacestrant可降低Ki67(增殖细胞相关抗原)标记指数41%并有助于提高肿瘤细胞周期停滞(CCA)率(表1)。其它TREAT ctDNA等与辅助治疗相关研究正在进行中(表2)1。
表2 口服SERD类药物相关试验信息(在研研究)
3) 安全性
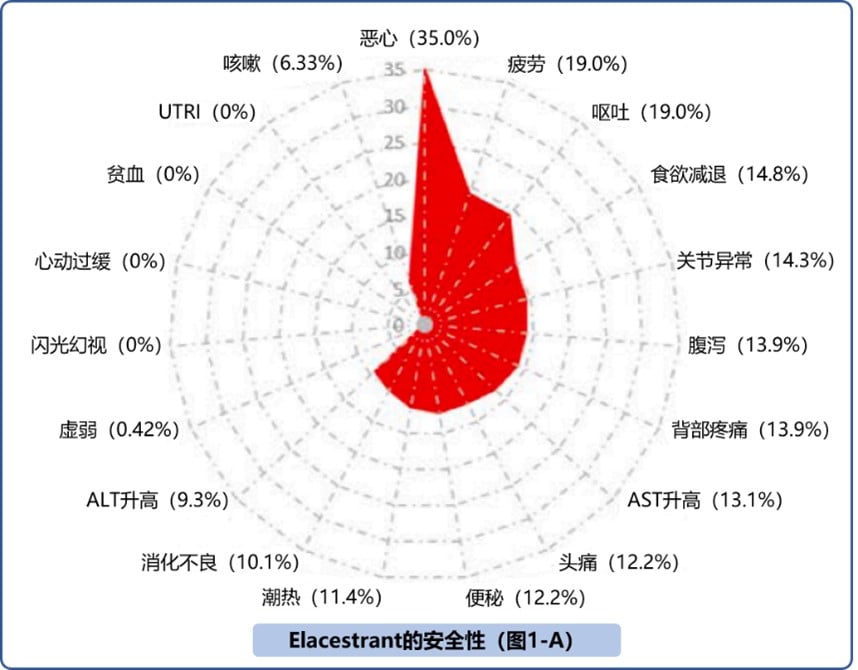
EMERALD研究中,Elacestrant治疗中最常见不良事件(AE)为恶心、呕吐、食欲下降等(图1-A)。除恶心、呕吐、食欲下降以外,Elacestrant治疗的安全性与SOC相似1。
2. Camizestrant在ER+乳腺癌中的应用
1) 转移性/晚期乳腺癌治疗
SERENA -2研究纳入曾接受≤1线ET后疾病进展(患者接受的CT≤1线)的ER+/ HER2-绝经后乳腺癌患者240例,评估Camizestrant 75mg/150mg与氟维司群间疗效及安全性差异。结果显示Camizestrant两组相比氟维司群组患者中位无进展生存期均显著提高(表1)1。
2) 乳腺癌术前治疗和辅助治疗
SERENA-3研究纳入初诊ER+/ HER2-原发性乳腺癌且计划根治的患者(表1)。结果显示Camizestrant治疗可使患者ER表达降低65%(无论剂量/疗程)。阶段2研究结束时患者Ki67标记指数降低均超过80%(无论剂量)。辅助治疗相关研究(CAMBRIA 1/2)正在进行中(表2)1。
3) 安全性
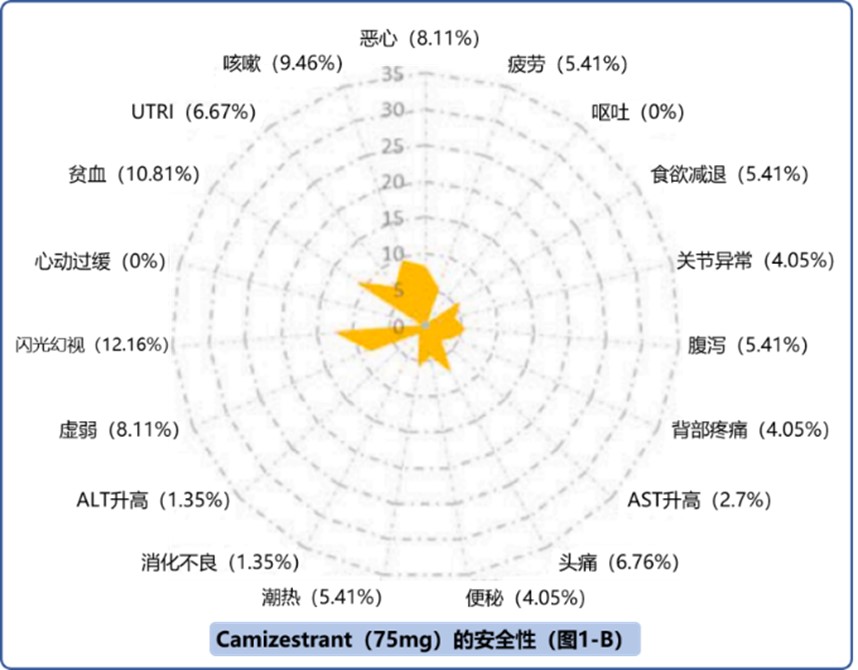
Camizestrant在SERENA 2研究中胃肠道副作用有限,常见AE包括心动过缓和闪光幻视(图1-B/C),严重程度均<3级。Camizestrant 75mg与氟维司群治疗中≥3级不良事件发生率在数据上相差不大(12.2% vs.15.1%)1。
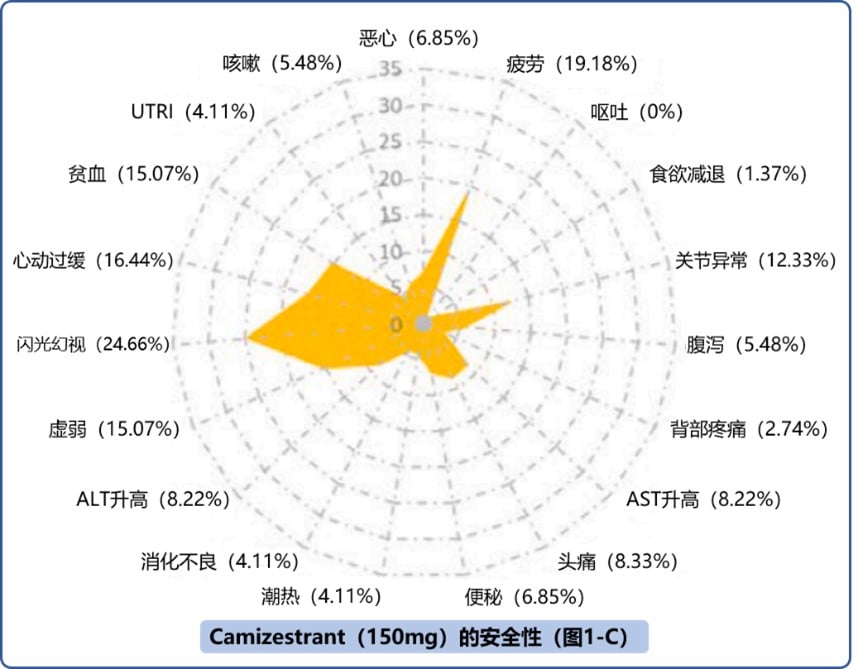
3. Giredestrant在ER+乳腺癌中的应用
1) 转移性/晚期乳腺癌治疗
acelERA研究显示Giredestrant治疗未达到主要终点(表1)。但一项Ib/II期试验的中期分析显示CDK4/6i+Giredestrant治疗的安全性良好,体现Giredestrant在联合用药方面具有一定价值。另有其它相关研究在研(表2)1。
2) 乳腺癌术前治疗和辅助治疗
术前治疗相关研究(lidERA)在研。辅助治疗方面,CoopERA研究纳入Ki67标记指数≥5%的绝经后ER+/ HER2-患者221例,评估Giredestrant与AI在序贯联合CDK4/6i方案下的疗效差异。结果显示(表1):研究组患者相比对照组在改善Ki67标记指数(81% vs. 74%)及CCA率方面更优(20% vs.14%)1。
3) 安全性
acelERA研究中(图1-D)Giredestrant 最常见的AE有恶心、转氨酶升高等,其中仅转氨酶升高一项中的少数(0.7%)报告为严重,且其它治疗相关严重AE发生率低(常见呕 吐和缺血性卒中,发生率均为1.3%)1。
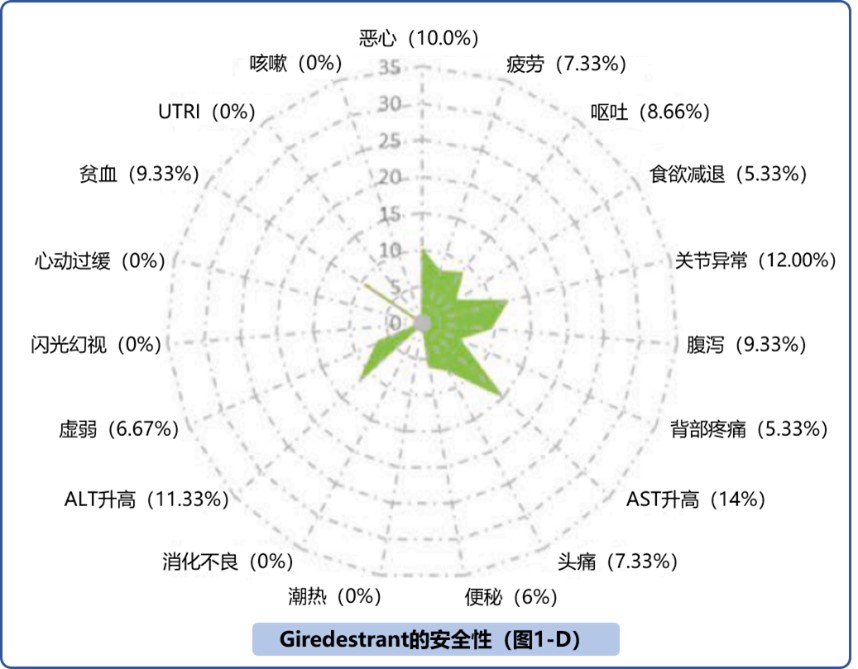
4. Imlunesterant在ER+乳腺癌中的应用
1) 转移性/晚期乳腺癌治疗
Imlunesterant单药治疗在既往EMBER-1试验中显示出良好的耐受性,且在接受过多种方案治疗的ER+/ HER2-晚期乳腺癌患者中表现药物活性。EMBER后续系列研究涉及与依维莫司、Alpelisib及曲妥珠单抗的联合治疗,目前正在进行中(表2)1。
2) 乳腺癌术前治疗和辅助治疗
EMBER-2试验纳入可手术治疗的I~III期ER+/ HER2-绝经后乳腺癌患者,设计上包含Imlunesterant 400/800mg两组,为期15天。结果显示两组患者的Ki67、ER及PR表达均下降,显示了Imlunesterant在术前治疗方面的价值。辅助治疗方面,相关研究EMBER-4尚在进行中(表2)1。
3) 安全性
EMBER-1试验中Imlunesterant(400mg)最常见的AE有恶心、疲劳、腹泻和关节痛(图1-E)。其中14%患者AE严重程度≥3级,以恶心和疲劳为主1。
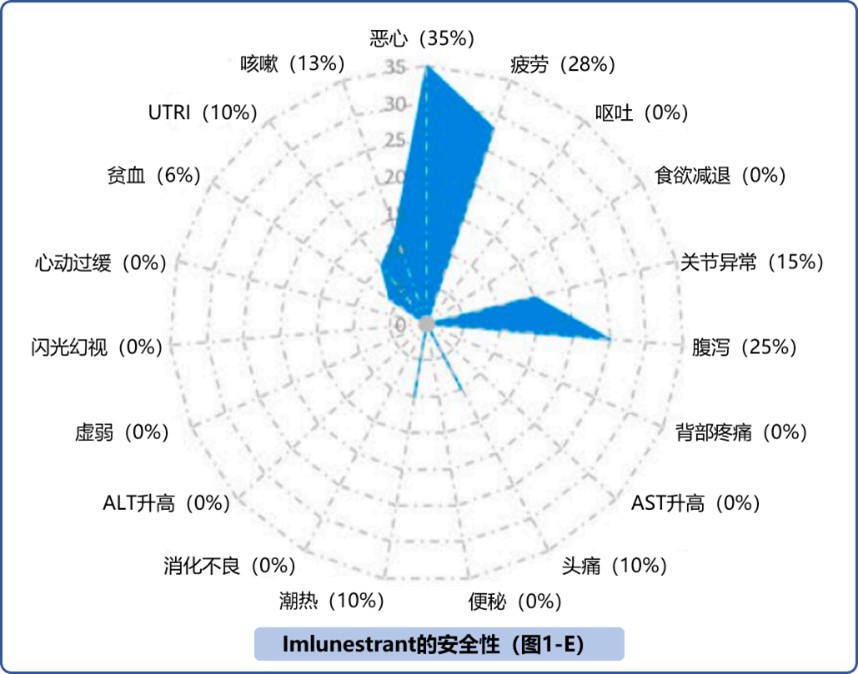
5. Amcenestrant在ER+乳腺癌中的应用
1) 治疗方面
既往I期试验中Amcenestrant治疗效果尚可,但后续II期及III期试验并未延续相似的结果。这些结果推动Amcenestrant相关的后续多项试验提前中止1。
2) 安全性
相关研究显示,Amcenestrant最常见的AE是恶心、呕吐、关节痛和背痛(图1-F)。其中16%的患者发生严重不良事件,但仅1例与治疗相关。此外另发生眼痛、视力模糊和闪光幻视各1例,严重程度均为1级1。
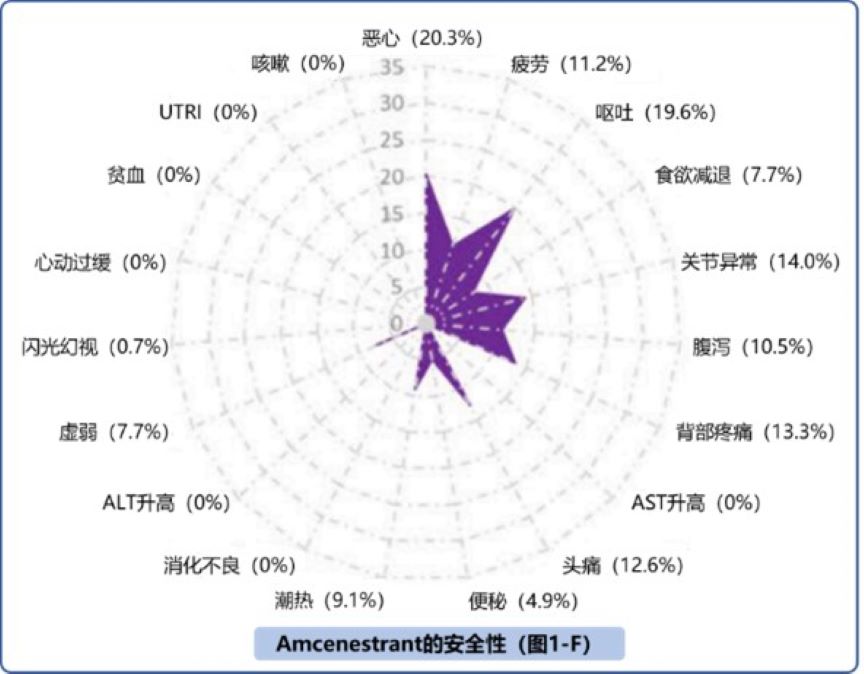
6.其它口服SERD在ER+乳腺癌中的应用
除上述药物外,尚有多种SERD处于研发状态,其中多数(如GDC-029等)受多种原因影响而中止研发,另一部分(如AND019、SCR-6852等)药物研发尚处于早期评估的结束阶段,目前尚不清楚新一代SERD 是否会在后期研发阶段提升SERD治疗的总体优势1。
总结
乳腺癌内分泌治疗已经迈入新时代。自2002年氟维司群获批以来,口服SERD类药物不断推陈出新。与氟维司群相比,这些SERD疗效更佳且兼具口服给药的优势。同时随着Elacestrant、Camizestrant、Giredestrant应用于乳腺癌术前治疗相关研究的逐步完成,有力推动了辅助+新辅助治疗联合策略的进一步完善。口服SERD类药物在一般情况下具有不错的安全性,在目前研究最广泛的此类药物中,不良事件的发生情况与传统ET之间存在部分重叠,但不同药物也有相对特异的不良事件。目前来看,口服SERD类药物对ER+乳腺癌治疗具有积极作用,但具体如何应用则尚不明确。此外,这些新型口服SERD类药物在绝经前人群中的应用问题,联合用药问题,以及更加具体化的安全性问题,仍需后续研究深入探索1。
参考文献:
1. Gheysen M, Punie K, Wildiers H, et al. Oral SERDs changing the scenery in hormone receptor positive breast cancer, a comprehensive review. Cancer Treat Rev. 2024 Sep 11;130:102825.
2. 房文通,郭明鑫,曹孟妲,等.选择性雌激素受体降解剂研究进展[J].药学进展,2024,48(02):125-133. 下载原文
3. Bidard FC, Kaklamani VG, Neven P, et al. Elacestrant (oral selective estrogen receptor degrader) Versus Standard Endocrine Therapy for Estrogen Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: Results From the Randomized Phase III EMERALD Trial. J Clin Oncol. 2022 Oct 1;40(28):3246-3256.
4. Martín M, Lim E, Chavez-MacGregor M, et al. Giredestrant for Estrogen Receptor-Positive, HER2-Negative, Previously Treated Advanced Breast Cancer: Results From the Randomized, Phase II acelERA Breast Cancer Study. J Clin Oncol. 2024 Jun 20;42(18):2149-2160.
5. Tolaney SM, Chan A, Petrakova K, et al. AMEERA-3: Randomized Phase II Study of Amcenestrant (Oral Selective Estrogen Receptor Degrader) Versus Standard Endocrine Monotherapy in Estrogen Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer. J Clin Oncol. 2023 Aug 20;41(24):4014-4024.
6. Maria Vidal, Tomás Pascual, Claudette Falato, et al. Elacestrant in postmenopausal women with estrogen receptor positive and HER2-negative early breast cancer: primary efficacy and safety analysis of thepre-operative, window of opportunity SOLTI-1905-ELIPSE trial. San Antonio Breast Cancer Symposium® December 6-10, 2022.
7. Hurvitz SA, Bardia A, Quiroga V, et al. Neoadjuvant palbociclib plus either giredestrant or anastrozole in oestrogen receptor-positive, HER2-negative, early breast cancer (coopERA Breast Cancer): an open-label, randomised, controlled, phase 2 study. Lancet Oncol. 2023 Sep;24(9):1029-1041.
8. Giorgi Dzagnidze,Christopher Morrow,Teimuraz Gogitidze,et al. A multiomic approach forcamizestrant-induced estrogen receptor (ER) degradation, antagonism and anti-proliferation: Exploratory analysis from SERENA-3. 2024 ESMO. Abstract 274P.



