本品用于治疗 18 岁及以上患者由鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎(HABP)、呼吸机相关性细菌性肺炎(VABP)。
本品不适用于治疗鲍曼- 醋酸钙不动杆菌复合体敏感分离株以外病原体所致HABP/VABP。
为减少耐药菌形成,维持本品和其它抗菌药物的有效性,本品仅用于治疗已证实或强烈疑似由敏感细菌引起的感染。当可获得培养及药敏信息,选择或调整抗菌治疗时应予以考虑。如缺少此类数据,根据经验进行治疗选择时可参考当地流行病学和药敏性特征信息。
(1)推荐剂量:
肌酐清除率(CLcr)为 45-129 mL/min 的成人患者,本品推荐剂量为 1.0 g 舒巴坦和 1.0 g 度洛巴坦,每 6 小 时进行一次静脉(IV)输注,每次持续 3 小时。
对于 CLcr<45 mL/min 和 CLcr≥130 mL/min 的患者,建议调整本品给药方案。
(2)疗程:
建议本品治疗持续时间为 7-14 天。应根据患者的临床状态,选择治疗持续时间。
- 对于 CLcr<45 mL/min 和肾功能亢进(CLcr≥130 mL/min)的患者,建议调整给药方案。
对于接受间歇性血液透析(HD)患者,在 HD 完成后立即开始本品给药。
对于肾功能波动患者,应监测 CLcr 并相应调整剂量。
表 1. 18 岁及以上患者根据肾功能的用药剂量推荐
| 舒巴坦和度洛巴 坦的剂量(g) | 估算的 CLcr (mL/min)a | 给药频率 |
|---|---|---|
| 舒巴坦 1.0g 和度洛巴坦 1.0g | ≥130 | 每4小时1次 |
45-129 | 每6小时1次 | |
30-44 | 每8小时1次 | |
15-29 | 每12小时1次 | |
<15b | 对于开始使用本品的患者:前 3 次给药每 12 小 时 1 次(0、12 和 24 小时),第 3 次给药后每 24 小时 1 次b 对于目前正在接受本品且 CLcr 下降至 15 mL/min 以下的患者:每 24 小时 1 次 |
aCLcr=用 Cockcroft-Gault 方程估算的肌酐清除率
b对于接受血液透析的患者,应在透析疗程结束后给药
接受连续性肾脏替代治疗(CRRT)的患者
在这种情况下,提供剂量调整的信息有限,应根据患者的临床状态指导治疗。在 CRRT 期间,患者的残余肾功能可能发生变化,可能需要调整本品剂量。治疗过程中肾功能可能发生变化,需定期监测肾功能,并相应调整本品剂量。
一项体外研究评估了舒巴坦/度洛巴坦在CRRT期间的清除率,并通过蒙特卡洛模拟探究给药方案。此外,有病例报告描述了舒巴坦/度洛巴坦在CRRT患者中的应用。
如您需要,请通过在线提问或邮箱/热线方式联系辉瑞医学信息部。
辉瑞医学信息部热线:400-910-0055
尚未评估肝功能损害对舒巴坦和度洛巴坦药代动力学的影响。因舒巴坦和度洛巴坦均未发生实质性肝脏代谢/排泄,预计肝功能损害不会影响本品消除。肝功能损害患者无需调整剂量。
(1)孕妇
本品
尚无在妊娠期间使用本品的数据用于评估发生重大出生缺陷、流产或其他母体或胎儿不良结局的药物相关风险。
舒巴坦
现有已发表的关于几十年来妊娠期间联合使用舒巴坦与氨苄西林的病例数据,尚未发现重大出生缺陷、流产或其他母体或胎儿不良结局的药物相关风险。已发表的文献报告了舒巴坦可穿过人体胎盘。已在小鼠、大鼠和家兔中以高达人体剂量 10 倍的剂量进行了生殖研究,未显示舒巴坦对胎仔造成伤害的证据。
度洛巴坦
尚无在妊娠期间使用度洛巴坦的数据用于评估发生重大出生缺陷、流产或其他母体或胎儿不良结局的药物相关风险。 妊娠小鼠和大鼠在器官形成过程中给予度洛巴坦未显示药物诱导的胎仔畸形,但在 2 倍和 4 倍人体最大推荐剂量(MRHD)时观察到小鼠的骨骼变异发生率增加。
(2)哺乳期妇女
尚无关于人体或动物乳汁中存在度洛巴坦的数据。人体乳汁中存在低浓度的舒巴坦。已发表的数据报告,假设婴儿平均乳汁摄入量为 200 mL/kg/天,预计摄入的母乳中舒巴坦最大日剂量为 560 mcg/kg/天(成人体重的 1%至 2%的校正剂量)。没有关于本品、舒巴坦或度洛巴坦对母乳喂养婴儿或乳汁产量影响的数据。
应同时考虑哺乳对婴儿发育和健康的益处、母亲对本品的临床需求以及本品或母亲基础状况对乳母喂养婴儿的任何潜在不良影响。
已知对本品成份(舒巴坦和度洛巴坦)或其他 β-内酰胺类抗菌药物有严重超敏反应史的患者应禁用本品。
(1)超敏反应
在接受 β-内酰胺类抗菌药物治疗的患者中曾报告严重和偶发致命性超敏反应(速发严重过敏反应)和严重皮肤反应。这些反应更容易发生在有 β-内酰胺类超敏反应史和/或对多种变应原有过敏史的个体。在本品临床试验中,接受本品治疗的患者有超敏反应发生。在开始本品治疗前,应仔细询问既往对碳青霉烯类、青霉素类、头孢菌素类、其他 β-内酰胺类和其他过敏原的超敏反应史。如果在使用本品时发生过敏反应,应停用本品。
(2)艰难梭菌相关性腹泻(CDAD)
几乎所有抗菌药物(包括本品)的应用都有艰难梭菌相关性腹泻(CDAD)的报告,其严重程度可表现为轻度腹泻至致死性结肠炎。抗菌药物治疗可引起结肠正常菌群的改变,导致艰难梭菌的过度生长。 艰难梭菌产生的毒素 A 和毒素 B 促使 CDAD 的发生和进展。艰难梭菌的高产毒株可导致发病率和死亡率增加,因为抗菌药物治疗可能对这些感染无效,有可能需要结肠切除。对于所有使用抗菌药物后出现腹泻的患者,必须考虑到 CDAD 的可能。由于曾经有给予抗菌药物治疗之后超过 2 个月发生 CDAD 的报道,因此需仔细询问病史。 如果怀疑或确诊 CDAD,应评估继续使用本品治疗的风险/获益。应根据临床指征开始适当的液体和电解质管理、蛋白质补充、艰难梭菌的抗菌治疗以及外科评估。
(3)耐药菌的产生
在未确诊或未高度怀疑细菌感染或作为预防性用药的情况下,本品不太可能对患者产生获益,且有增加耐药菌产生的风险。
(1)严重不良反应和终止治疗
在 III 期试验的随机、活性对照部分,本品治疗组的 36 例患者(40%)和多粘菌素 E 治疗组的 42 例患者(49%)发生了严重不良反应。11%(10/91)接受本品治疗的患者和 16%(14/86)接受多粘菌素 E 治疗的患者因出现不良反应而终止治疗。1 例接受本品治疗的患者出现过敏性休克,导致终止治疗。
(2)常见不良反应
本品治疗组 88%(80/91)的患者和多粘菌素 E 治疗组 94%(81/86)的患者报告了不良反应。接受本品治疗患者中最常报告的不良反应(>10%)为肝功能检查异常、腹泻、贫血和低钾血症。表 2 列出了试验 1 中发生率>5%的不良反应。
表 2. III 期试验中发生率>5%的不良反应
不良反应 | XACDURO | 多粘菌素E |
|---|---|---|
任何不良反应 | 80(88) | 81(94) |
肝功能检查异常a | 17(19) | 18(21) |
腹泻 | 15(17) | 9(11) |
贫血 | 12(13) | 12(14) |
低钾血症 | 11(12) | 9(11) |
心率失常 | 8(9) | 8(9) |
急性肾损伤b | 5(6) | 31(36) |
血小板减少症 | 5(6) | 3(4) |
便秘 | 5(6) | 5(6) |
a肝功能检查异常包括以下不良反应:肝功能检查异常、肝功能异常、转氨酶升高、丙氨酸氨基转移酶升高和天门冬氨酸氨基转移酶升高;
b急性肾损伤包括以下不良反应:肾功能损害、血肌酐升高、中毒性肾病、肾衰和急性肾损伤。
与有机阴离子转运蛋白 1(OAT1)抑制剂合并给药可能会增加舒巴坦的血药浓度。不建议本品与 OAT1 抑制剂(如丙磺舒)合并给药。
临床研究
一项在健康受试者中开展的临床研究,未观察到度洛巴坦、舒巴坦、亚胺培南和西司他丁之间的药物-药物相互作用。
未对药物相互作用潜力进行进一步临床评价的体外研究:在治疗性血浆浓度下,度洛巴坦不抑制 CYP1A2、CYP2A6、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、
CYP2E1 或CYP3A4。度洛巴坦无体外诱导 CYP1A2、CYP2B6 或CYP3A4 的潜力。未开展 CYP450 和舒巴坦的体外研究。
膜转运系统 :
体外数据显示,在治疗性血浆浓度下,舒巴坦不抑制 P-gp、BCRP、OATP1B1、
OATP1B3、OCT1、OCT2、BSEP、OAT1、OAT3、MATE1 或 MATE2-K。体外数据还表明,在治疗性血浆浓度下,度洛巴坦不抑制 P-gp、BCRP、OATP1B1、OAT1、OAT3或 OCT2。舒巴坦和度洛巴坦均为 OAT1 的底物。但是,预计主动分泌作用仅为舒巴坦总清除率的重要部分,因此,抑制 OAT1 可能会增加舒巴坦的血浆浓度。尚未开展本品和 OAT1 抑制剂的临床研究。
与其他抗菌药物的相互作用
体外研究显示,本组合包装产品与其他抗菌药物(包括头孢他啶-阿维巴坦、亚胺培南、美罗培南、阿米卡星、多粘菌素 E、头孢吡肟、环丙沙星、米诺环素、利福平、利福昔明、达托霉素、达巴万星、奥利万星、特地唑胺、非达霉素、万古霉素、利奈唑胺、甲硝唑和氟康唑)之间无拮抗作用。
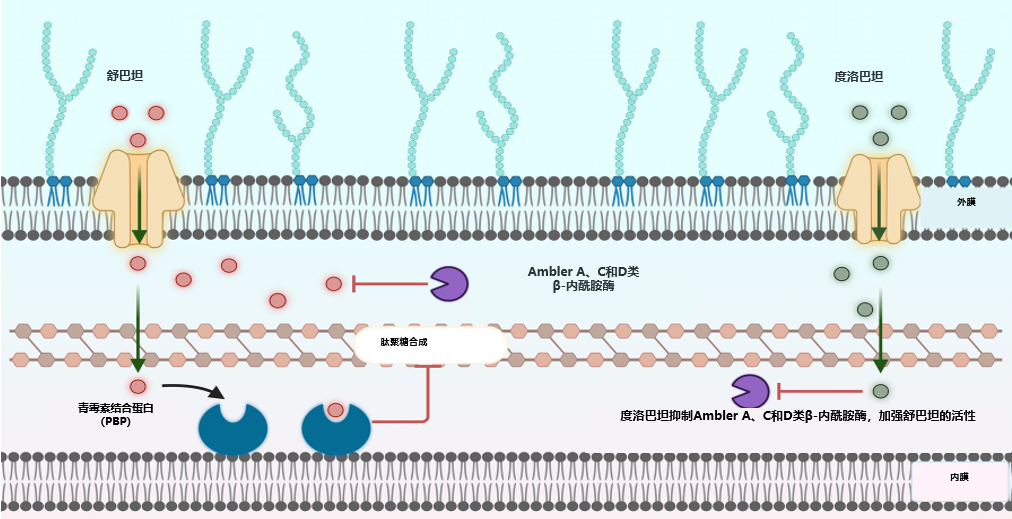
舒巴坦:
β-内酰胺类抗菌药物,对不动杆菌属具有抗菌活性
通过结合鲍曼不动杆菌的PBP(青霉素结合蛋白)1和PBP3,阻止其参与细菌细胞壁的合成过程,产生对鲍曼不动杆菌的杀菌活性
度洛巴坦:
二氮杂二环辛烷、非β-内酰胺类的β-内酰胺酶抑制剂,可抑制A、C和D类β-内酰胺酶
保护舒巴坦不被β-内酰胺酶降解,恢复舒巴坦的抗菌活性
图1. 舒巴坦-度洛巴坦机制示意图
在可能的情况下,临床微生物实验室应定期向医生报告并提供其所在医院使用的抗菌药物的相关体外药敏性试验结果,该结果可反映医院及社区获得性病原菌的药敏特点。这些报告可帮助医生在治疗时选择抗菌药物。
稀释法
通常采用定量方法测定抗菌药物的最小抑菌浓度(MIC)值。MIC 用于评估细菌对抗菌化合物的敏感性。应使用标准化的实验方法(微量肉汤稀释法)测定本品 MIC。舒巴坦联合固定浓度 4μg/mL 度洛巴坦的 MIC 值应通过系列稀释确定。应根据表 6 中的标准对 MIC 进行判读。
扩散法
通过测量抑菌圈直径的定量法也可用于重复估计细菌对抗菌药物的敏感性。应使用标准化的实验方法测定抑菌圈直径。使用含有 10μg 舒巴坦和 10μg 度洛巴坦的纸片检测微生物对本品的敏感性。纸片扩散法判读标准见表 3。
表 3. 舒巴坦-度洛巴坦药敏试验结果判读标准
| MIC(mcg/mL) | 纸片扩散法抑菌圈直径(mm) | |||||
|---|---|---|---|---|---|---|
| 病原体 | S | I | R | S | I | R |
| 鲍曼-醋酸钙 不动杆菌复合体 | ≤4/4 | 8/4 | ≥16/4 | ≥17 | 14-16 | ≤13 |
S = 敏感; I = 中介; R = 耐药
报告结果为“敏感(S)”时,表示如果抗菌药物在感染部位达到通常浓度时,很可能会抑制病原体的生长。报告结果为 “中介( I )”时,表示细菌引起的感染仅在应用高剂量抗菌药物时有效,或者细菌处于体内抗菌药物浓缩的部位或体液中时才被抑制。报告结果为 “耐药(R)”时,表示即使抗菌药物在感染部位达到通常浓度,也可能无法抑制病原体生长,应选择其他疗法。
标准化药敏试验程序需要采用实验室质控措施,以监测并确保本试验所用材料和试剂的准确度和精密性,以及试验执行人员的操作方法正确。标准的本品粉末采用微量肉汤稀释法应能得出表4 列出的MIC值范围。使用10μg舒巴坦和10μg度洛巴坦纸片扩散法应该能达到下表4 所示的标准。
表 4. 舒巴坦-度洛巴坦药敏试验可接受的质量控制范围
| 参比菌株 | MIC范围(μg/mL)a | 纸片扩散法 |
|---|---|---|
| 鲍曼不动杆菌 NCTC 13304 | 0.5/4-2/4 | 24-30 |
a舒巴坦联合固定浓度 4 μg/mL 度洛巴坦的 MIC。
对于舒巴坦,已证明未结合血浆舒巴坦浓度高于对鲍曼不动杆菌最小抑菌浓度(MIC)的时间占给药间期百分比(%fT>MIC)是动物和体外感染模型中疗效的最佳预测指标。
对于度洛巴坦,24 小时未结合血浆度洛巴坦 AUC 与舒巴坦-度洛巴坦 MIC 的比值(fAUC0–24/MIC)可最佳预测体内和体外感染模型中的活性。
根据体外和体内研究数据,舒巴坦%fT > MIC值为 50% 与 1-log10菌落形成单位(CFU)减少相关;对于度洛巴坦,当未结合的舒巴坦达到 50% fT > MIC 时,fAUC0–24/MIC比率约为 10 和 30时分别与实现 1-log10 和 2-log10 CFU减少相关。4,5
使用群体药代动力学(PPK)模型、非临床PK/PD数据和体外监测数据评估不同最低抑菌浓度(MIC)模拟鲍曼-醋酸钙不动杆菌(ABC)感染患者的达标概率(PTA)。使用与1-log10杀菌相关的PK/PD目标,在模拟患者中,对于MIC ≤ 4 µg/mL的病原体,在所有肾功能类别中,PTA均≥ 90%。6
舒巴坦和度洛巴坦单次和多次给药后的药代动力学相似。
舒巴坦的 Cmax 和 AUC 随剂量成比例增加(0.5 倍推荐单次给药剂量至 1.0 g 单次给药剂量)。
度洛巴坦在研究的剂量范围内(0.25 倍推荐单次给药剂量至 2 倍推荐单次给药剂量,每 6 小时输注 1 次,每次持续 3 小时)显示出与剂量成比例的药代动力学。
本品各组分药代动力学特征以及舒巴坦和度洛巴坦的药代动力学参数总结见表5
表 5. 本品各组分的药代动力学特征(平均值±SD)
药代动力参数 | 舒巴坦 | 度洛巴坦 |
|---|---|---|
Cmax(μg/mL)a | 32.4±24.7 | 29.2±13.2 |
AUC0-24 (h·µg/mL)a | 515±458 | 471±240 |
分布 |
|
|
与人血浆蛋白结合百分比 | 38% | 10% |
AUC0-6 ELF/血浆比率 | 0.5 | 0.37 |
Vss (L)a | 25.4±11.3 | 30.3±12.9 |
代谢 | 代谢极少 | |
消除 |
|
|
CL(L/h)a | 11.5±5.64 | 9.96±3.11 |
T1/2(h)a | 2.15±1.16 | 2.52±0.77 |
排泄 |
|
|
主要消除途径 | 肾脏 | |
原形经尿液排泄的百分比 | 75%-85% | 78% |
a显示数值为在给药剂量为 1.0 g 舒巴坦和 1.0 g 度洛巴坦每 6 小时一次的肾功能正常(定义为肌酐清除率≥90 mL/min 且<130 mL/min)患者中的稳态(第 3 天)药代动力学参数。
AUC0-6 = 从给药时至给药后 6 小时的血浆浓度时间曲线下面积;AUC0-24 = 从给药时至 24 小时的血浆浓度时间曲线下面积;CL = 清除率;Cmax = 峰浓度;ELF = 上皮细胞衬液;SD = 标准差,T1/2= 终末半衰期;Vss = 稳态分布容积
基于年龄(18-91 岁)、性别、体重(35-150 kg)和人种(白人、黑人、亚洲人、美国印第安人/阿拉斯加原住民、其他),未观察到舒巴坦或度洛巴坦具有临床意义的药代动力学差异。
在一项评价肾功能损害对舒巴坦和度洛巴坦药代动力学影响的单次给药试验中,与 CLcr≥90 mL/min 的健康受试者相比,所有肾功能损害水平下舒巴坦和度洛巴坦的剂量标准化的全身暴露量均较高(表 6)。在接受血液透析的终末期肾脏疾病(ESRD)受试者中,舒巴坦和度洛巴坦通过血液透析清除的剂量分数分别为 0.41 和 0.33。
表 6. 与 CLcr≥90mL/min 的受试者相比,肾功能损害受试者剂量标准化的 AUC 增加倍数
估计 eGFR(mL/min/1.73 m2) | 舒巴坦 | 度洛巴坦 |
|---|---|---|
≥60 且<90 | 1.4 | 1.4 |
≥30 且<60 | 2.0 | 1.9 |
<30 | 4.3 | 3.7 |
为维持与肾功能正常患者相似的全身暴露量,建议肾功能损害患者调整剂量。接受血液透析的患者应在血液透析完成后接受本品治疗。
在 CLcr≥130 mL/min 的患者中观察到舒巴坦和度洛巴坦清除率升高。每 4 小时输注一次本品(1.0g 舒巴坦和 1.0g 度洛巴坦),每次持续 3 小时,舒巴坦和度洛巴坦暴露量与 CLcr 为 90-129 mL/min 的患者暴露量相当。
舒巴坦和度洛巴坦主要经肾脏清除;因此,肝功能损害不太可能对本品暴露量产生任何影响。
ATTACK [ClinicalTrials.gov ID: NCT03894046]是一项多中心III 期试验,研究包含两个部分,A部分是评估者设盲、随机对照试验,B部分是开放标签观察性研究。研究旨在评估舒巴坦/度洛巴坦与多粘菌素E对鲍曼-醋酸钙不动杆菌复合体(ABC)引起的严重感染患者的疗效和安全性。

*剂量:根据肾功能调整舒巴坦/度洛巴坦的剂量,根据体重和肾功能调整多粘菌素E剂量。对于先前未接受多粘菌素E治疗的患者,在第1天单次静脉输注2.5-5mg /kg的负荷剂量,时间为3-6分钟。
ABC:鲍曼-醋酸钙不动杆菌复合体; CRAB:碳青霉烯类耐药的鲍曼不动杆菌;TOC:治愈访视;q6/12h:每6/12小时一次
A部分共128例患者经实验室确认CRABC感染(CRABC m-MITT人群),B部分共有28例患者接受了开放标签舒巴坦/度洛巴坦治疗。CRABC m-MITT 人群的 128 例患者治疗组之间的基线特征具有可比性,如下表所示。
表 7. CRABC m-MITT 人群的基线特征
| A部分 | B部分 | |
|---|---|---|---|
| 舒巴坦/度洛巴坦(n=64) | 多粘菌素E(n=64) | 舒巴坦/度洛巴坦(n=28) | |
年龄,岁 | 62 (54-75) | 66 (53-80) | 59 (46-67) |
男性 | 46 (72%) | 49 (77) | 21 (75%) |
地区 |
|
|
|
北美 | 1 (2%) | 0 | 0 |
欧洲 | 31 (48%) | 21 (33%) | 23 (82%) |
拉丁美洲 | 9 (14%) | 9 (14%) | 1 (4%) |
亚太 | 8 (13%) | 15 (23%) | 1 (4%) |
中国 | 15 (13%) | 19 (30%) | 3 (11%) |
肌酐清除率<90mL/min | 25 (39%) | 26 (41%) | 7 (25%) |
APACHE II评分 | 16 (5) | 17 (5) | 18 (5) |
SOFA评分 | 3 (4) | 4 (6) | 6 (20) |
感染类型 |
|
|
|
血流感染 | 2 (3%) | 1 (2%) | 17 (61%) |
医院获得性肺炎 | 24 (38%) | 31 (48%) | 4 (14%) |
呼吸机相关肺炎 | 38 (59%) | 30 (47%) | 7 (25%) |
通气性肺炎 | 0 | 2 (3%) | 0 |
Charlson共病指数 | 5 (3) | 5 (3) | 3 (3) |
脓毒症 | 7 (11%) | 12 (19%) | 3 (11%) |
机械通气 | 47 (73%) | 50 (78%) | 8 (29%) |
随机化时ICU住院时间 |
|
|
|
未在ICU住院 | 21 (33%) | 19 (30%) | 5 (18%) |
<5天 | 2 (3%) | 3 (5%) | 1 (4%) |
5-14天 | 23 (36%) | 24 (38%) | 4 (14%) |
>14天 | 18 (28%) | 18 (28%) | 18 (64%) |
病原体 |
|
|
|
单菌种 | 37 (58%) | 45 (70%) | 23 (82%) |
多菌种 | 27 (42%) | 19 (30%) | 5 (18%) |
首次给药前24小时内使用抗生素 | 54 (84%) | 60 (94%) | 24 (86%) |
A部分多菌种感染的患者中大部分为ABC加另一种革兰阴性菌(85%,39/46)。最常见的共感染革兰阴性菌为肺炎克雷伯菌,其次为铜绿假单胞菌。4例患者同时感染了嗜麦芽窄食单胞菌,5例同时感染奇异变形杆菌。其他共感染革兰阴性分离株包括木糖氧化无色杆菌(Achromobacter xylosoxidans)、大肠埃希菌(Escherichia coli)、产酸克雷伯菌(Klebsiella oxytoca)和粘质沙雷菌(Serratia marcescens)。
基线175株ABC分离株送往中心实验室进行了全面的抗菌药敏感性测试,显示出高度抗菌药物耐药性(依据CLSI判读标准)。17% (20/175)对多粘菌素E耐药(MIC > 4 μg/mL),91% (159/175)对舒巴坦耐药(MIC > 8 μg/mL)。
表 8. ABC基线分离株特征
类别 | ABC基线分离株占比 | 舒巴坦/度洛巴坦 | 舒巴坦/度洛巴坦 |
|---|---|---|---|
CARB-R | 96% | 0.5-16 | 2/4 |
MDR | 96% | 0.5-16 | 2/4 |
XDR | 85% | 0.5-16 | 2/4 |
PDR | 15% | 1-8 | 2/4 |
CARB-R:碳青霉烯类耐药(MIC>4 μg/mL);MDR:对至少3类用于治疗ABC的抗菌药物不敏感;PDR:对所有测试的批准用于治疗ABC的抗菌药物类别均不敏感;XDR:除两类抗菌药物类别外,对所有用于治疗ABC的抗菌药物类别均不敏感。舒巴坦/度洛巴坦在4 μg/mL度洛巴坦下对不同浓度舒巴坦进行测试。
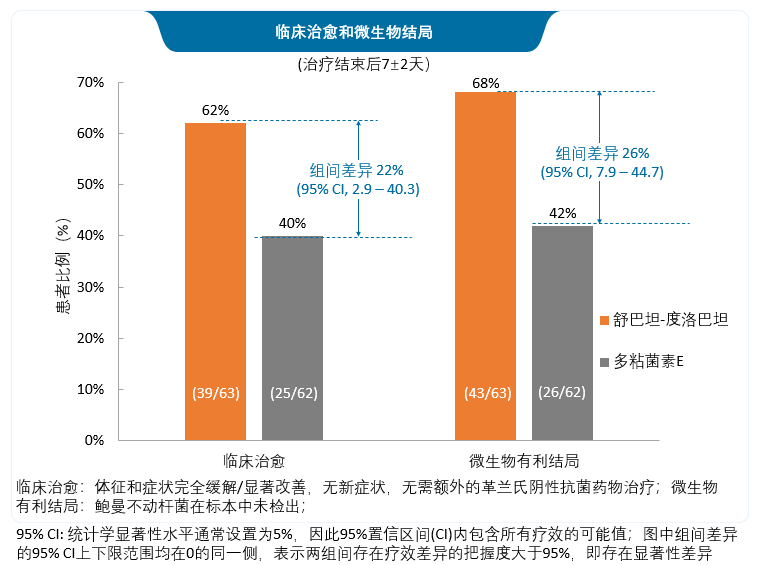
舒巴坦/度洛巴坦治疗的28天全因死亡率非劣于多粘菌素E,临床治愈率和微生物结局显著优于多粘菌素E。
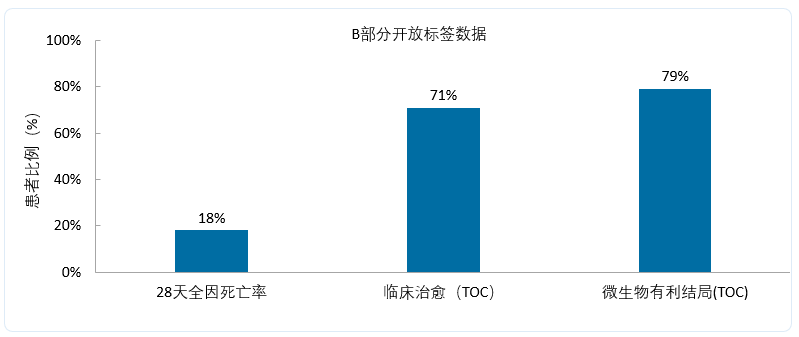
B部分舒巴坦/度洛巴坦治疗的临床应答结果与A部分一致。
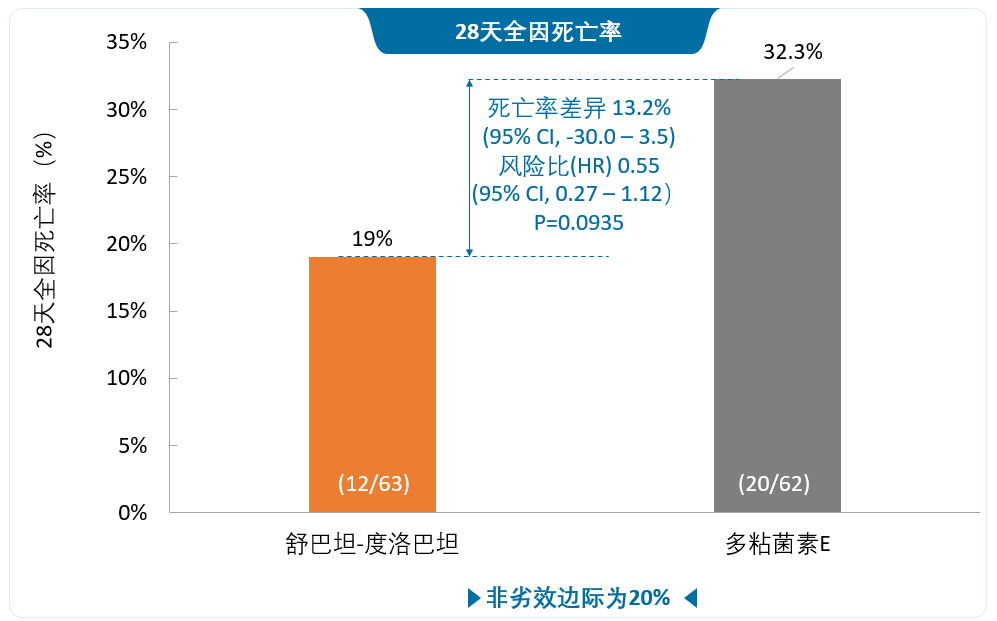
Kaplan-Meier分析显示,从治疗第6天开始,使用舒巴坦/度洛巴坦治疗的患者相比多粘菌素E治疗的患者具有显著更高的生存率。在CRABC m-MITT人群中,第14天的死亡时间风险比为0.32(95% CI 0.10–0.98;p=0.035),第28天的死亡时间风险比为0.55(95% CI 0.27–1.12;p=0.094)。
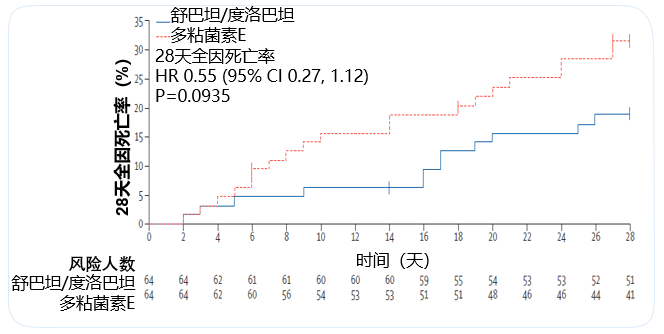
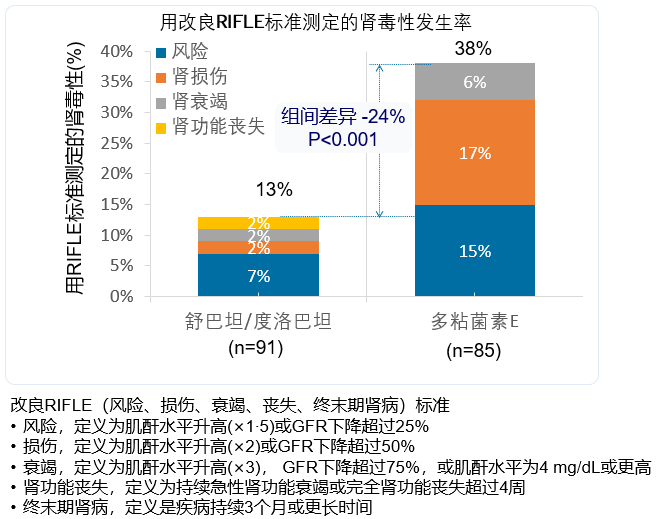
安全性分析人群包括A部分的177例(98%)患者和B部分的28例患者(100%)。主要安全终点是至第42天通过检测肌酐水平或肾小球滤过率,使用改良风险、损伤、衰竭、丧失、终末期肾病(RIFLE)标准评估的肾毒性发生率。舒巴坦/度洛巴坦组肾毒性发生率显著低于多粘菌素E组(13% (12/91) vs 38% (32/85), p<0.001)。
舒巴坦/度洛巴坦组和多粘菌素E组安全性概况如下表所示,A部分两组患者治疗中任意不良事件的发生率分别为88%和94%,两组分别报告了36例(40%)和42例(49%)严重不良事件;分别有10例(11%)和14例(16%)患者因治疗中出现的不良事件(TEAE)导致停药。
A部分 | A部分 | B部分 | |
|---|---|---|---|
任意TEAE | 80 (88%) | 81 (94%) | 24 (86%) |
特别关注的TEAE | 31 (34%) | 38 (44%) | 8 (29%) |
过敏或超敏反应 | 15 (16%) | 10 (12%) | 0 |
突发感染或超级感染 | 17 (19%) | 25 (29%) | 4 (14%) |
艰难梭菌结肠炎或感染 | 1 (1%) | 6 (7%) | 0 |
研究药物相关TEAEa | 11 (12%) | 26 (30%) | 3 (11%) |
严重不良事件 | 36 (40%) | 42 (49%) | 9 (32%) |
药物相关严重不良事件 | 1 (1%) | 2 (2%) | 1 (4%) |
肺炎 | 1 (1%) | 1 (1%) | 0 |
假膜性结肠炎 | 0 | 1 (1%) | 0 |
中性粒细胞减少症 | 0 | 0 | 1 (4%) |
导致停药的不良事件 | 10 (11%)b | 14 (16%)c | 4 (14%) |
TEAE:治疗中出现的不良事件;
a研究药物相关TEAE不包括与亚胺培南-西司他丁相关的不良事件,并基于设盲评估者的评估;如果设盲评估缺失,则使用未设盲的主要研究者的评估。
b1例不良事件被认为与舒巴坦/度洛巴坦相关:超敏反应,n=1。
c4例不良事件被认为与多粘菌素E相关:急性肾损伤,n=2;皮疹,n=1;癫痫发作,n=1。
ATTACK研究中,亚胺培南/西司他丁被用作舒巴坦/度洛巴坦组与多粘菌素E组的背景治疗,根据研究方案,有以下考虑:
亚胺培南/西司他丁是对两组中多菌种感染患者的大多数共感染病原体的有效治疗方法。7
亚胺培南/西司他丁是对碳青霉烯类敏感 ABC 感染的首选药物,也是多粘菌素E组中治疗碳青霉烯类耐药ABC (CRABC) 的合适搭配。有数据表明,碳青霉烯类抗生素与多粘菌素E联合在治疗CRABC感染时可能没有协同作用,但也没有显示出负面影响。7
对于舒巴坦/度洛巴坦组中CRABC 单菌种感染的患者,若在随机分配后停止亚胺培南/西司他丁治疗,则会导致治疗分配揭盲。因此所有患者都继续接受亚胺培南/西司他丁的背景治疗。7
亚胺培南/西司他丁每 6 小时一次的剂量方案与舒巴坦/度洛巴坦一致。7
为了评估度洛巴坦与舒巴坦和亚胺培南/西司他丁联合治疗CRABC感染的疗效,研究也要求不停止碳青霉烯类抗生素的使用。ATTACK研究微生物学分析报告显示,舒巴坦/度洛巴坦加或不加亚胺培南/西司他丁,对基线ABC分离株的总体体外活性基本相同。7,9
研究讨论部分和方案中提到,对照药物的选择具有挑战性。新型β-内酰胺-β-内酰胺酶抑制剂均对碳青霉烯类耐药ABC(CRABC)无效。因此,多粘菌素E仍然是管理广泛耐药革兰氏阴性菌感染的推荐抗生素。有研究表明,碳青霉烯类药物与多粘菌素联用在体外对鲍曼不动杆菌具有增强的活性。在全球范围内,大多数ABC菌株是多重耐药(MDR)的,在研究启动时,常用的治疗方案包括多粘菌素E单独或联合碳青霉烯类药物。7
研究设计时考虑了使用“最佳可用治疗”作为对照的可能性,但尚无明确的标准治疗。此外,由于研究规模和可能对比较疗效评估造成混淆,认为这不是令人满意的选择。基于这些考虑,研究使用多粘菌素E作为对照,亚胺培南-西司他丁用作研究两组的背景治疗。7
舒巴坦/度洛巴坦已获批用于治疗 18 岁及以上患者由鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎(HABP)、呼吸机相关性细菌性肺炎(VABP)。
一项多中心、随机、活性对照、非劣效性 III 期试验(ATTACK)评估了舒巴坦/度洛巴坦与多粘菌素E对鲍曼-醋酸钙不动杆菌复合体(ABC)引起的严重感染患者的疗效和安全性。由于预计对大部分潜在的共感染细菌有效,研究中使用亚胺培南/西司他丁作为舒巴坦/度洛巴坦组与多粘菌素E组的背景治疗。对于125例实验室确诊CRABC感染的患者,舒巴坦/度洛巴坦治疗的28天全因死亡率非劣效于多粘菌素E(19% vs 32%,差异:–13.2% (95% CI –30.0 to 3.5))。7
ATTACK研究微生物学分析报告通过累积抑制百分比和气泡图比较显示,舒巴坦+度洛巴坦的组合中添加或不添加亚胺培南,总体体外活性基本相同。9
从全球超过30个国家收集的AB临床分离株的体外药物敏感性试验显示,鲍曼-醋酸钙不动杆菌复合体对舒巴坦-度洛巴坦的敏感率超过96%。10-12中国的鲍曼-醋酸钙不动杆菌复合体临床分离株在体外对舒巴坦-度洛巴坦的敏感率高达98%。13
声明:
请注意,以下指南/指导中的推荐意见不代表辉瑞公司立场。辉瑞对第三方网站内容或服务不承担任何责任或义务。我们建议您查看您可能选择访问网站的相关政策和条款。
如需指南共识原文,请您联系辉瑞医学信息部:[email protected], 或通过辉瑞医学信息网站在线提问获取。
IDSA 2024 Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections
对于碳青霉烯类耐药鲍曼不动杆菌(CRAB),建议使用包含舒巴坦的抗生素方案治疗。首选方案是舒巴坦/度洛巴坦联合碳青霉烯类药物(如亚胺培南/西司他丁或美罗培南)。14
舒巴坦的肺组织渗透率(50%-61%) ,针对舒巴坦/度洛巴坦的系统综述显示,健康受试者显示出良好的肺组织渗透率即上皮细胞衬液(ELF)/两种药物总血药浓度比值(度洛巴坦为38%、舒巴坦为50%,如果考虑未结合的药物则分别为41%和81%),支持舒巴坦/度洛巴坦用于CRAB致肺部感染的治疗。 15
对于实验室报告痰液或无菌身体部位标本中存在不动杆菌,抗菌药物敏感性待定的:如果当地MDR/碳青霉烯类耐药率>10-15%,或患者病情危重,考虑联合治疗以增加至少用到一种有效药物的几率。推荐的经验性治疗方案包括:
- 舒巴坦/度洛巴坦 1g/1g IV q6h 输注3h + 亚胺培南/西司他丁 1g IV q6h 输注1h;或
- 氨苄西林/舒巴坦 6g/3g IV q8h 输注4h + 美罗培南 2g IV q8h 输注3h + 多粘菌素B 2.5mg/kg IV输注2h,后1.5mg/kg IV q12h 输注1h。
对于实验室报告对所有头孢菌素、氨曲南和碳青霉烯类药物耐药,对多粘菌素类敏感的不动杆菌:建议感染性疾病会诊。 推荐方案包括舒巴坦/度洛巴坦 + 亚胺培南/西司他丁 ;或氨苄西林/舒巴坦 + 美罗培南 + 多粘菌素B;剂量同上。
对于实验室报告对所有检测抗生素(包括多粘菌素类)耐药的不动杆菌:尚无已知有效治疗,建议感染性疾病会诊。推荐方案包括舒巴坦/度洛巴坦 + 亚胺培南/西司他丁 ;考虑头孢地尔 2g q8h IV 输注3h + 米诺环素 200mg IV q12h。
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
1. 鼎优乐(注射用舒巴坦钠/注射用度洛巴坦钠组合包装)产品说明书
2. McLeod SM, et al. Future Microbiol . 2024;19(7): 563-576
3. Anand A, et al. Health Sci Rep . 2024 Sep 9;7(9):e70066
4. O'Donnell JP, Bhavnani SM.. Clin Infect Dis. 2023 May 1;76(Suppl 2):S202-S209.
5. O'Donnell J, Tanudra A, Chen A, et al. Antimicrob Agents Chemother. 2024 Jan 10;68(1):e0080023.
6. Bhavnani SM, et al. Open Forum Infect Dis. 2022 Dec 15;9(Suppl 2):ofac492.1896.
7. Kaye KS, et al. Lancet Infect Dis 2023; 23: 1072–84
8. McLeod SM, et al.Open Forum Infect Dis. 2024;11(4):ofae140.
9. Miller AA, , et al. Antimicrob Agents Chemother. 2024;68(5):e0169823.
10. Seifert H, et al. J Antimicrob Chemother . 2020 Sep 1;75(9):2616-2621;
11. McLeod SM, et al. Antimicrob Agents Chemother . 2020 Mar 24;64(4):e02534-19
12. Karlowsky JA, et al. Antimicrob Agents Chemother. 2022 Sep; 66(9): e00781-22
13. Yang QW, et al. J Antimicrob Chemother . 2020 Jul 1;75(7):1833-1839.
14. Tamma PD, et al. Clin Infect Dis. 2024 Aug 7:ciae403.
15.中华医学会神经外科学分会,中国神经外科重症管理协作组等. 中国现代神经疾病杂志,2024,24(6):407-424.
16. Chambers H, et al. Sanford Guide: Acinetobacter baumannii-calcoaceticus complex. 2024.



