前言
ADC类药物是由特定的抗体、化疗药物和连接子组成的抗体偶联药物,旨在实现在癌症细胞中精准释放药物,减少对身体正常细胞或组织的损害。近年来,在乳腺癌领域,ADC类药物取得重大进展。自2013年以来,FDA先后批准恩美曲妥珠单抗(T-DM1)、德曲妥珠单抗(T-DXd)和戈沙妥珠单抗(SG)用于不同分子分型乳腺癌患者的治疗。此外,多款ADC类药物[如 trastuzumab duocarmazine (SYD985),datopotamab deruxtecan(Dato-DXd)和patritumab deruxtecan(HER3-DXd)]正在乳腺癌领域展开积极探索1。
尽管ADC类药物在提高靶向性和减少毒性方面取得了显著进展,但ADC类药物引起的不良反应并不少见,且毒性谱显示出不同于传统化疗及靶向药物的特征,严重者可导致治疗方案调整,甚至造成死亡,临床中需予以格外关注。本文针对ADC类药物的AE(不良事件)机制、常见AE及其管理进行阐述与探讨。
ADC类药物不良反应发生机制
ADC类药物的不良反应主要与荷载物的释放、连接子的稳定性以及ADC的内吞作用有关。ADC类药物通过在肿瘤微环境中释放载荷发挥其肿瘤杀伤作用,但在正常组织中释放则会导致毒性。通常, ADC类药物的毒性与正常组织表达ADC类药物靶点相关, 但也有可能是脱靶效应引起。
相同细胞毒载荷的ADC类药物往往呈现出类似的不良反应谱,如含微管蛋白抑制剂DM1的ADC往往会造成肝毒性、血小板减少;含拓扑异构酶Ⅰ抑制剂DXd、SN-38等的ADC则往往会导致脱发、腹泻和中性粒细胞减少,携带奥瑞他汀类衍生物的ADC类药物通常导致外周神经病变2。此外偶联的单抗可能会引起ADC类药物独特的毒性,其机制可能是ADC类药物与肿瘤细胞之外的抗原结合导致载荷在非肿瘤组织累积,如T-DM1或T-DXd的心脏毒性、HER3-DXd的血小板减少等。另外,ADC还可能诱导间质性肺病(ILD),其机制目前尚不清楚,可能与其Fc结构域以及非恶性细胞等表达的FcγRs相互作用相关,如具高表达FcγR的肺泡巨噬细胞吞噬T-DXd后可能导致ILD。
ADC类药物常见毒性特征
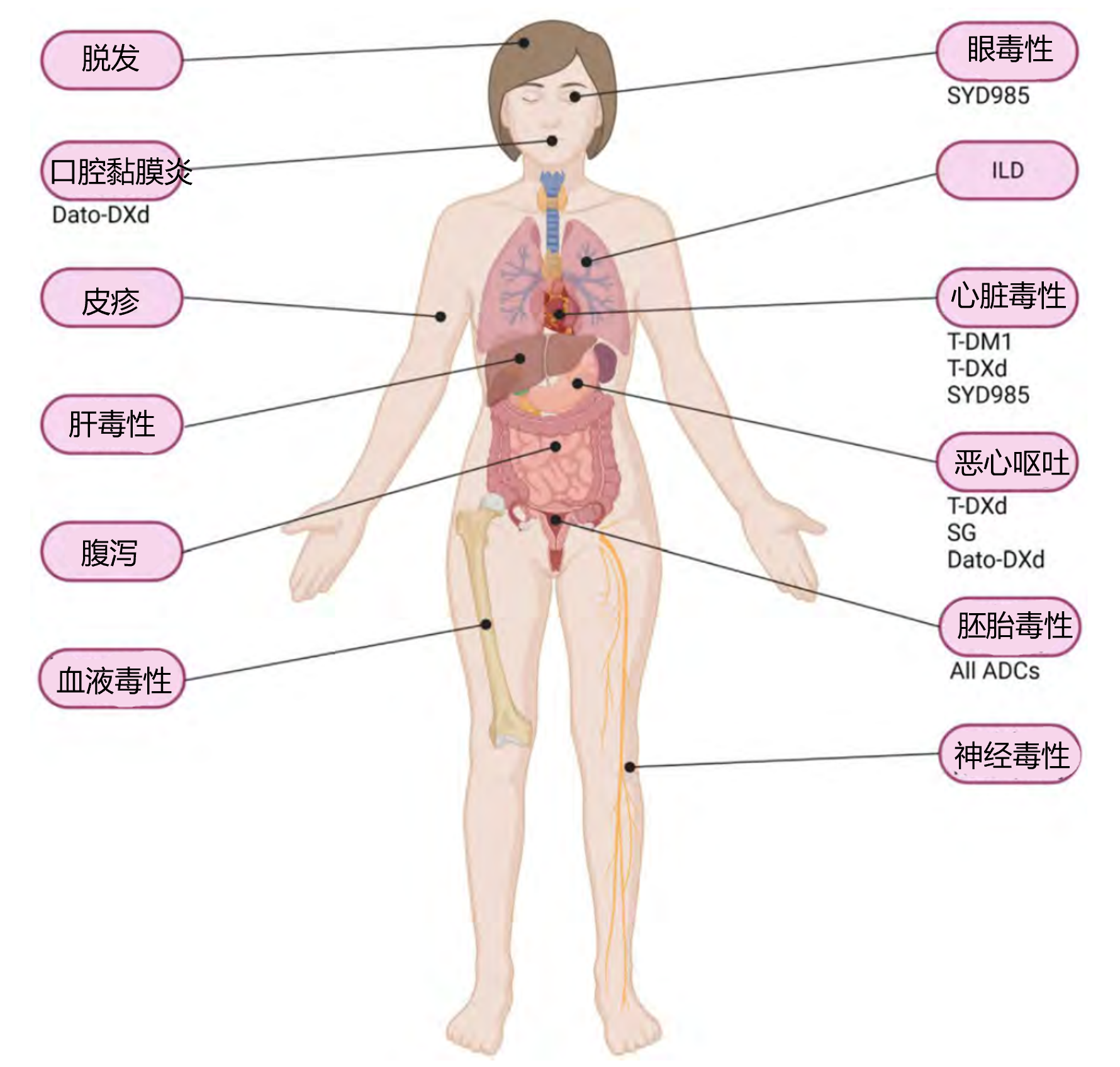
图1 ADC类药物在乳腺癌中的主要AEs
常规毒性
血液学毒性
血液学毒性是ADC类药物的常见AEs,包括全血细胞减少症、中性粒细胞减少症、贫血和血小板减少症,通常与所载化疗药物的细胞毒性相关。如果治疗不当,严重的血液学AE可能导致并发症,如出血、中性粒细胞减少性发热以及潜在的后续感染甚至脓毒症。
不同ADC类药物的高发血液学毒性存在一定差异。在接受T-DM1治疗的患者中,血小板减少症是最常见的3-4级血液学毒性(45.1%);T-DXd和SG最常见的3-4级血液学毒性为中性粒细胞减少症(分别为16%和49.5%)和发热性中性粒细胞减少症(分别为1.1%和6.6%),T-DXd治疗的患者通常在治疗第54天发作,持续时间3周左右,而SG治疗的患者发作时间更早、持续时间较短,通常在首个疗程后第15天发生,持续8天;Dato-DXd最常见的3-4级血液学毒性为贫血(4%);HER3-DXd最常见的3-4级血液学毒性为中性粒细胞减少症(39.6%)和血小板减少症(30.8%),通常发生在初次治疗的第1~第2周内,中位持续时间为8天(表1)。
表1 不同ADC类药物的常见血液学毒性
| 药物 | 最常见3-4级血液学AE | AE的起始/终止时间 |
|---|---|---|
| T-DM1 | 血小板减少症(45.1%) | 第8天最低 下一次计划用药时恢复 |
| T-DXd | 中性粒细胞减少症(16%) 发热性中性粒细胞减少症(1.1%) |
中位发作时间是第54天(范围:第1天~第18个月) 首次发作的中位持续时间为22天(范围:第2天~第9.0个月) |
| SG | 中性粒细胞减少症(49.5%) 发热性中性粒细胞减少症(6.6%) |
第一个疗程后中性粒细胞减少症的中位发作时间是第15天 中性粒细胞减少症的中位持续时间为8天 |
| Dato-DXd | 贫血(4%) | 未报道 |
| HER3-DXd | 中性粒细胞减少症(39.6%) 血小板减少症(30.8%) |
中性粒细胞减少症和血小板减少症的中位发作时间分别是第8天和第12天 中性粒细胞减少症和血小板减少症的中位持续时间均为8天 |
胃肠道毒性
胃肠道毒性是ADC药物的常见AEs,同样与细胞毒药物载荷相关,主要包括恶心呕吐、腹泻、口腔黏膜炎等。在ADCs药物中,T-DXd、SG和HER3-DXd的恶心发生率较高(约70%),T-DXd和SG的呕吐发生率较高(约50%),临床需予以特别关注。腹泻方面,ADCs药物中SG的腹泻发生率最高,任意级别腹泻发生率约60%,其中约9%≥3级。口腔黏膜炎是Dato-DXd最常见的不良事件之一,所有级别和≥3级口腔炎的发生率分别为50-70%和10-15%,其他ADC类药物的黏膜炎发生率约为10-20%,以轻中度为主。
表2 不同ADC类药物的常见胃肠道毒性1,3-7
| 药物 | 恶心 | 呕吐 | 腹泻 | 口腔黏膜炎 |
|---|---|---|---|---|
| T-DM1 | 任意:30% ≥3级:0.4% |
任意:10% ≥3级:0.8% |
任意:7% ≥3级:0.4% |
任意:5% ≥3级:0% |
| T-DXd | 任意:76% ≥3级:7% |
任意:49% ≥3级:1.6% |
任意:29% ≥3级:1.2% |
任意:20% ≥3级:0.8% |
| SG | 任意:69% ≥3级:6% |
任意:49% ≥3级:6% |
任意:63% ≥3级:9% |
任意:14% ≥3级:1% |
| Dato-DXd | 任意:66% ≥3级:2% |
任意:39% ≥3级:5% |
任意:16% ≥3级:0% |
任意:50%~70% 3-4级:10%~15% |
| SYD985 | 任意:15%~18% ≥3级:0% |
任意:12%~13% ≥3级:0% |
任意:3%~6% ≥3级:1% |
任意:16%~21% ≥3级:3% |
| HER3-DXd | 任意:67.9% ≥3级:0% |
任意:25.6% ≥3级:0% |
任意:24.4% ≥3级:1.3% |
- |
肝毒性
天冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)升高是T-DM1最常见的≥3级AE(10%),也是导致T-DM1剂量延迟或减少的最常见原因。
表3 不同ADC类药物的肝毒性发生率3-6
| 转氨酶升高 | T-DM1 | T-DXd | SG | Dato-DXd | SYD985 | HER3-DXd |
|---|---|---|---|---|---|---|
| AST升高 | 任意:83% ≥3级:5% |
任意:67% ≥3级:1% |
任意:45% ≥3级:3% |
- | 任意:6% ≥3级:1% |
任意:7.7% ≥3级:0% |
| ALT升高 | 任意:67% ≥3级:6% |
任意:53% ≥3级:2% |
任意:35% ≥3级:2% |
- | - | 任意:11.5% ≥3级:2.6% |
周围神经毒性
周围神经病变(PN)是ADCs治疗相关的最常见不良事件之一,患者通常永远无法完全康复。在接受ADCs治疗的患者中,约40%发生PN,23.3%出现≥3级感觉减退,11%的患者因PN停止治疗。根据EudraVigilance数据库,T-DM1治疗期间神经系统疾病发生率为16.2%,在T-DXd、HER3-DX、Dato-DXd和SYD985的临床试验中未观察到PN。
特殊毒性
心脏毒性
心脏毒性是HER2靶向药物已知的潜在AEs之一,包括QT间期延长、心律失常、心肌缺血、高血压、左心室功能障碍(LVD)和心力衰竭(HF)。在EMILIA研究中,T-DM1组有1.7%的患者左心室射血分数(LVEF)<50%,至少15%的患者LVEF低于基线水平。在DESTINY-Breast01研究中,T-DXd组LVEF下降比例约1.6%,4.9%的患者报告任意级别的QT间期延长,其中1.1%为≥3级QT间期延长。在DESTINY-Breast03研究中,11.9%的患者LVEF下降10%~19%,1.5%的患者LVEF下降超过20%。在SYD985 I期试验中,剂量爬坡和剂量拓展队列分别有5%和8%的患者报告LVEF下降。
眼毒性
ADC类药物在治疗中可能引发眼部毒性,其中SYD985需要特别关注。眼部毒性是SYD985的显著不良反应,其发生机制与药物成分特性有关。在III期TULIP试验中,SYD985治疗组中78.1%的患者发生眼部毒性(而对照组医生选择的方案为29.2%),其中21.2%为3级及以上毒性,分别有20.8%和22.9%的患者因眼部毒性停药或减少药物剂量。
间质性肺病(ILD)
ILD是一组异质性的肺部疾病,其特点是肺间质、小气道和/或肺泡水平的炎症和/或纤维化。最常见症状是呼吸困难,其他症状可能包括咳嗽、不适、胸痛、低氧血症和发热。不同ADC药物引起ILD的风险有所不同,接受T-DXd治疗的患者ILD发生率较高(10.5%~13.6%),T-DM1、HER3-DXd和SG等ADC类药物的临床试验中报告的ILD病例则较少。
皮肤相关不良事件
脱发和皮疹等皮肤相关不良事件也是ADC类药物的常见AEs,可能对患者生活质量或治疗意愿产生不利影响,临床中应予以关注。
ADC类药物毒性管理
不同ADC类药物的不良反应种类和程度存在差异。使用ADC类药物期间应密切关注其可能引起的不良反应,并积极采取预防和治疗措施。对于产生严重后果的不良反应,给予对症处置方案,同时调整ADC类药物的剂量,必要时应予停药处理。对于较复杂的不良反应,需及时开展多学科会诊,制定解决方法8。
对于常见不良反应,大多与化疗载荷药物相关,临床中已积累了丰富的管理经验,临床中参考化疗相关毒性的处理原则即可。对于ADC药物的剂量调整,通用策略为:(1)1级大多无需特殊处理;(2)2级需暂停给药直至不良反应恢复至≤1级,之后按原剂量给药或降低1个剂量水平(若恢复时间>3周)继续治疗;(3)3~4级不良反应需暂停给药直至不良反应恢复至≤1级,之后降低1个剂量水平继续治疗;若3周内仍不恢复,应考虑终止治疗9。特殊关注的不良事件(如心脏毒性、眼毒性、ILD等)目前尚缺乏基于药物处方或指南的剂量调整建议9。一般建议,在应用ADC药物之前,应对患者全面评估,包括个人史和家族史,充分纠正心血管病等危险因素,规范治疗心血管疾病等合并症,眼科定期评估,必要时及时干预处理8。ILD尽管发生率较低,但一旦发生后果非常严重,甚至可能造成死亡,因此,对于疑似ILD/肺炎症状,应立即咨询肺部专家进行监测和治疗建议;对于出现≥2级ILD/肺炎症状的患者,应立即开始激素治疗且永久停用ADC药物。
讨论
ADC类药物被誉为“生物导弹”,其研发初衷旨在提高药物活性、显著降低毒副作用和治疗相关并发症。事实上,相比化疗,目前已获批的大多数ADC类药物均显示出更好的安全性和显著的疗效优势,在HR+乳腺癌治疗中也已获得一席之地,但ADC类药物依然难以避免部分“化疗相关”的副作用(如血液学毒性、恶心/呕吐、腹泻等),同时一些新型不良事件(如眼毒性、ILD)也需要临床专家重点关注。
值得一提的是,在HR+/HER2-乳腺癌领域,CDK4/6抑制剂联合内分泌治疗仍是HR+/HER2-晚期乳腺癌的标准治疗方案。CDK4/6抑制剂仅阻断细胞周期,不会诱导骨髓细胞等凋亡,因此血液学、胃肠道相关的安全性及管理要优于化疗、ADC类药物。目前,CDK4/6抑制剂在临床疗效、安全性以及患者生活质量三个维度均获得临床医生认可。三种CDK4/6i在显著延长患者生存期的同时,哌柏西利需要关注中性粒细胞减少,临床需要监测血常规,可通过调整用药周期或药物剂量解决进行管理;瑞波西利除血液学毒性外,临床发现QT间期延长这一不良反应,需要密切监测心电图。此外,阿贝西利需要关注腹泻、静脉血栓栓塞等,临床除血常规外,还需监测血清电解质水平及血栓栓塞指征。
作为乳腺癌新一代的靶向性抗癌药物,ADC在乳腺癌领域中的临床应用刚刚开始,仍需积累毒性管理相关经验,以期为患者带来更长的生存时间和更优的生活质量。
参考文献
1. D'Arienzo A, et al. EClinicalMedicine. 2023 Jul 27;62:102113.
2. Tarantino P, et al. Nat Rev Clin Oncol. 2023 Aug;20(8):558-576.
3. 注射用德曲妥珠单抗说明书(FDA版)
4. 注射用戈沙妥珠单抗说明书(NMFA版)
5. Oliveira M, et al. Ann Oncol. 2023 Aug;34(8):670-680.
6. Banerji U, et al. Lancet Oncol. 2019 Aug;20(8):1124-1135.
7. 2022 SABCS Abstract P6-10-03
8. 抗体偶联药物安全性跨学科管理中国专家共识(2023).
9. 中国乳腺癌抗体药物偶联物安全性管理专家共识(2022).



