
乳腺癌是全球范围内最常见的恶性肿瘤,是全球30~60岁女性患者死亡的主要原因[1]。乳腺癌的亚型是临床实践中影响治疗和预后的关键因素[1],激素受体(HR)+人表皮生长因子受体(HER2)-亚型最常见[2],因此类患者疾病负担沉重,临床上需不断优化相应的治疗手段及策略。目前,化疗、内分泌治疗及靶向治疗是乳腺癌治疗的三大重要手段[1],近年来免疫治疗作为新型的抗肿瘤治疗策略在实体瘤中得到广泛应用,并已在HER2+及三阴性乳腺癌(TNBC)领域取得一定成果[3],但关于HR+乳腺癌免疫治疗的应用仍在探索中。近年来,学术界对肿瘤微环境(TME)的认识不断深入,为HR+乳腺癌免疫治疗的发展注入新动力。本文梳理近年来与TME相关HR+乳腺癌免疫治疗机制的探索内容,总结当下HR+乳腺癌免疫治疗实践成果及未来发展方向,以期为临床工作者提供参考。
一、 HR+乳腺癌的肿瘤微环境与肿瘤免疫治疗
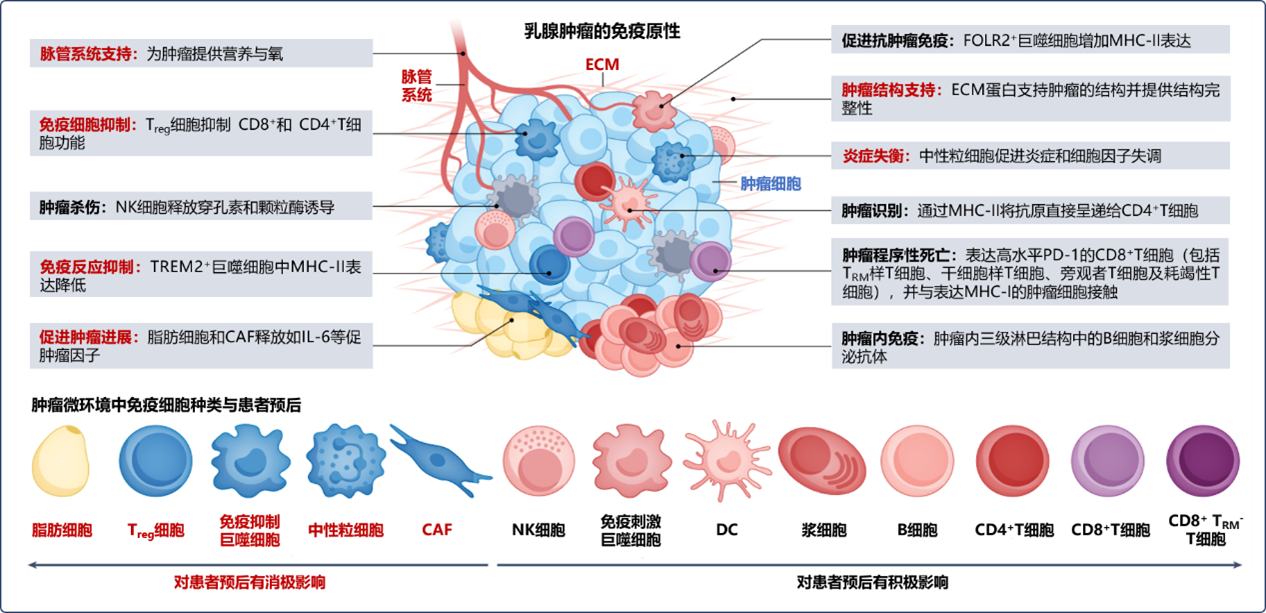
肿瘤免疫治疗与TME密不可分。TME是由肿瘤细胞、免疫细胞、内皮细胞、成纤维细胞及其它成分相互串扰而构造的集合体,其中蕴含免疫治疗所需的靶点[1]。目前认为TME对肿瘤免疫治疗而言利弊参半,其环境中的不同组分对肿瘤的发生发展具有不同影响[1]。就乳腺肿瘤而言,其TME表现高度复杂性,其中同时存在抗肿瘤免疫的促进和抑制机制。促免疫因素对患者预后有积极影响,而免疫抑制因素则与患者预后不良相关(见图1)[1]。
表格改编自:中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2024.分子分型部分
a建议将PR20%阳性作为 Luminal A 与 Luminal B分型界定的临界值;b癌细胞核中阳性染色细胞占比
HR:激素受体;ER:雌激素受体;PR:孕激素受体;HER:人表皮生长因子受体;Ki-67:增殖标志物Ki-67,一种与细胞增殖有关并可能是细胞增殖所必需的核蛋白;TNBC:三阴性乳腺癌
图1 免疫原性乳腺肿瘤的肿瘤微环境
肿瘤的免疫原性特征可通过TME免疫细胞的相对丰度体现(其中不考虑脂肪细胞,因为单细胞测序技术下该细胞类型相对丰度可能被低估)。而不同乳腺肿瘤亚型(分型方法见表1)[4]各自代表性的免疫细胞丰度存在差异[1]。
表1 乳腺癌分子分型

总体上,Luminal型肿瘤(尤其是Luminal A型)的TME中免疫浸润细胞种类相对更少,其中Luminal A型TME中以T细胞及肿瘤相关巨噬细胞(TAM)浸润为主,而Luminal B型TME中除T细胞及TAM外,还表现少数肿瘤相关成纤维细胞(CAF)和树突状细胞浸润(DC)。尽管TNBC通常被认为是最具免疫原性的亚型,但有证据表明,HER2过度表达型和高表达HR+的Luminal B型同样含有相对高丰度的肿瘤浸润淋巴细胞(TIL),且相比于被认为是免疫沙漠(无免疫浸润、肿瘤增殖较快的肿瘤)的Luminal A型相比,免疫靶点表达更丰富。具有免疫抑制及免疫刺激作用的TAM已在所有四种乳腺肿瘤亚型中被发现,其中Luminal A型中的丰度较低,目前尚需进一步研究以对每种乳腺肿瘤亚型中的TAM亚群进行分类(各亚型中免疫细胞浸润情况及相对丰度见图2)[1]。
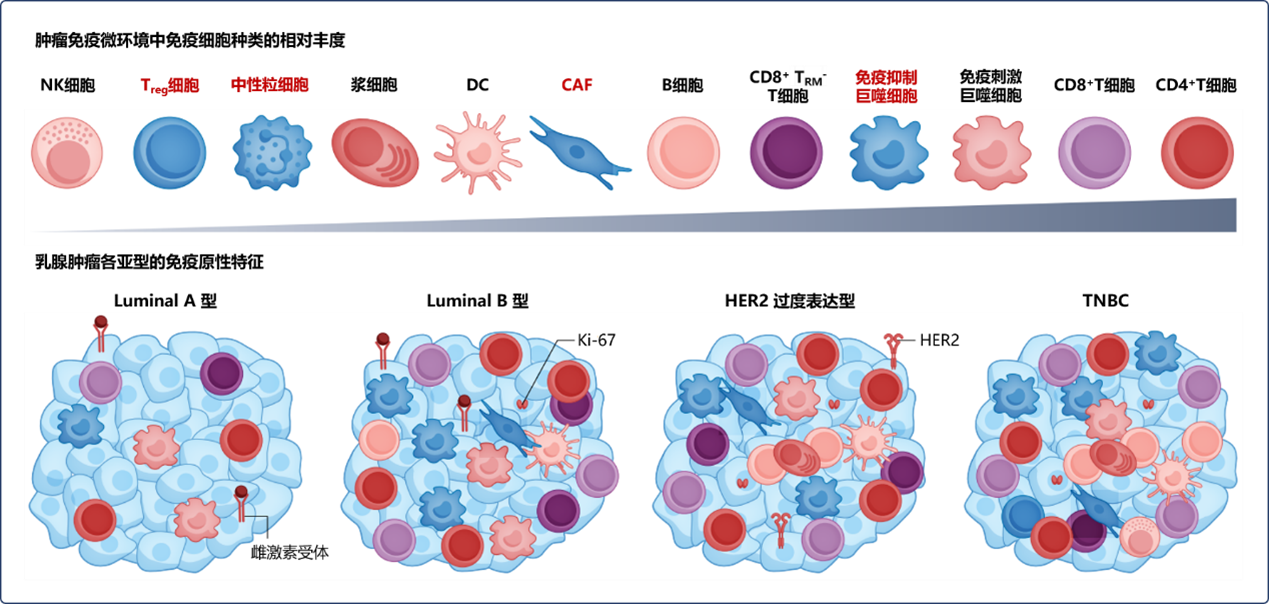
图片改编自:Towards targeting the breast cancer immune microenvironment. Fig.2a, b
红字标识组分为免疫抑制因素;黑字标识组分为促免疫因素
NK细胞:自然杀伤细胞; Treg细胞:调节性T淋巴细胞; DC:树突状细胞; CAF:肿瘤相关成纤维细胞; TRM:组织驻留记忆T细胞;Ki-67:增殖标志物Ki-67,一种与细胞增殖有关并可能是细胞增殖所必需的核蛋白;HER2:人表皮生长因子受体-2;TNBC:三阴性乳腺癌;TME:肿瘤微环境;TIL:肿瘤浸润淋巴细胞; CD8/4:白细胞分化抗原-8/4
图2 TME及乳腺肿瘤各亚型中免疫细胞的相对丰度
二、 雌激素受体通路及其相关治疗对乳腺肿瘤微环境的影响
绝经后妇女乳腺组织中芳香化酶水平升高可导致TME中雌激素水平升高,这与肿瘤细胞中雌激素受体(ER)α亚基表达相关。研究发现,雌激素可通过肿瘤细胞上的ER信号传导机制促进肿瘤疾病进展,也可通过增加叉头框蛋白P3(FOXP3)和程序性死亡受体1(PD-1)表达而促进调节性T淋巴细胞(Treg)介导的免疫抑制,并可导致髓源性抑制细胞(MDSC)浸润增加,增强信号传导及转录激活蛋白3(STAT3)通路以抑制T细胞功能[1]。
在治疗方面,动物试验发现抑制芳香化酶活性可增加ER+乳腺肿瘤中T细胞浸润,在卵巢切除小鼠中,联合芳香化酶抑制剂治疗方案可通过阻断雌激素信号传递,增强雌激素不敏感模型肿瘤的免疫原性。而在体外试验中发现,联合芳香化酶抑制剂治疗方案有助于增强自然杀伤细胞对乳腺肿瘤细胞的毒性。且芳香化酶抑制剂可上调样本肿瘤基质中的 CD8+TIL水平,并下调Treg细胞水平[1]。此外,细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂也在动物实验中被证实在T细胞增殖分化中发挥关键作用,并具有消耗Treg的能力[5],也有研究显示其可增加ER+患者处理后肿瘤样本的炎性反应及PD-1表达[1]。
三、HR+乳腺癌的免疫治疗实践
近年来,学术界在HR+乳腺癌免疫治疗领域进行了广泛探索。对不同分期、分型的HR+乳腺癌人群制定了靶向单药、靶向多药及靶向联合其它治疗等多种方案,并取得了一定的成果(见表2),目前对HR+乳腺癌免疫治疗的进一步研究多数尚在进行中。
表2 部分HR+乳腺癌免疫治疗临床研究要点总结
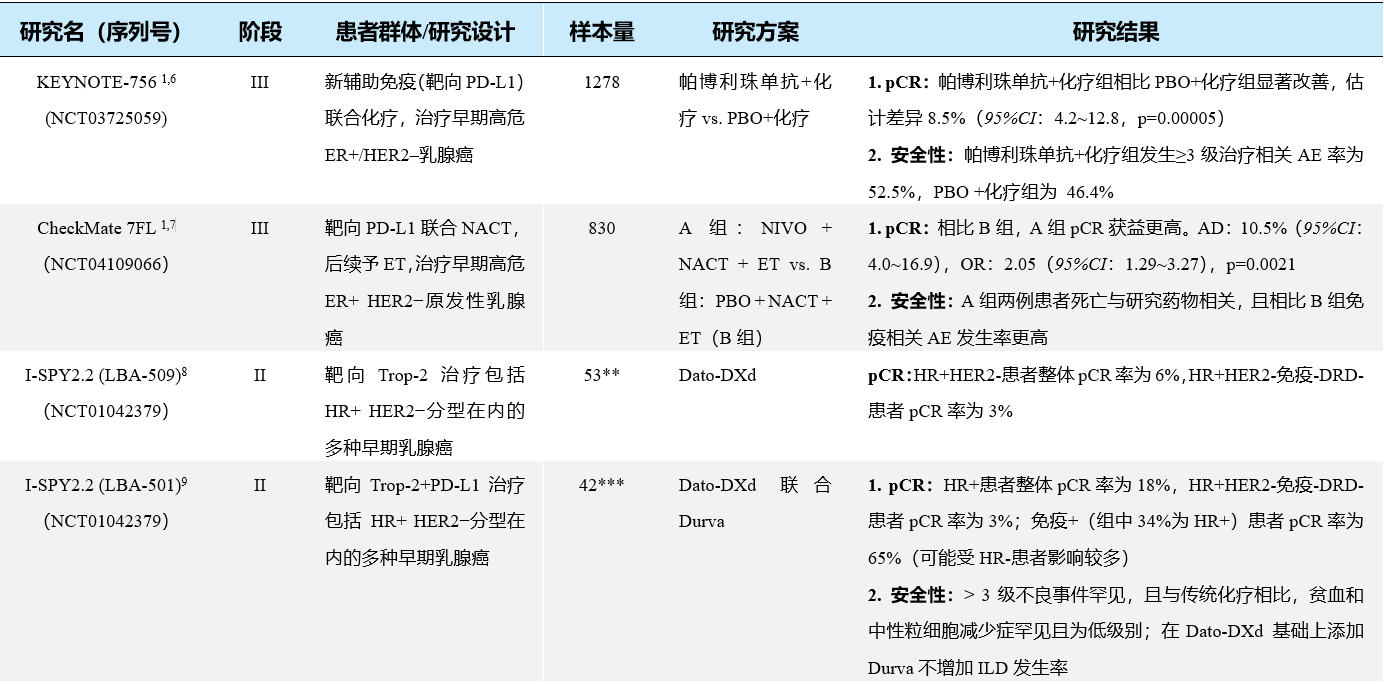
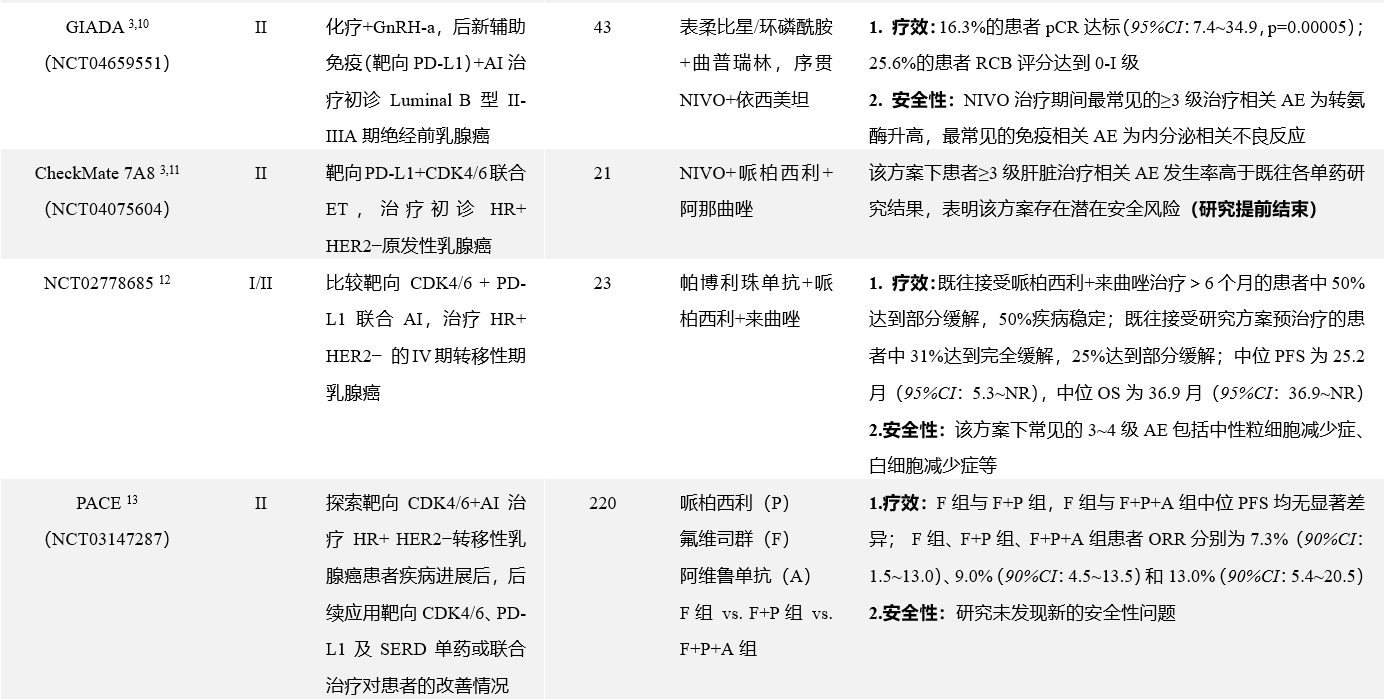
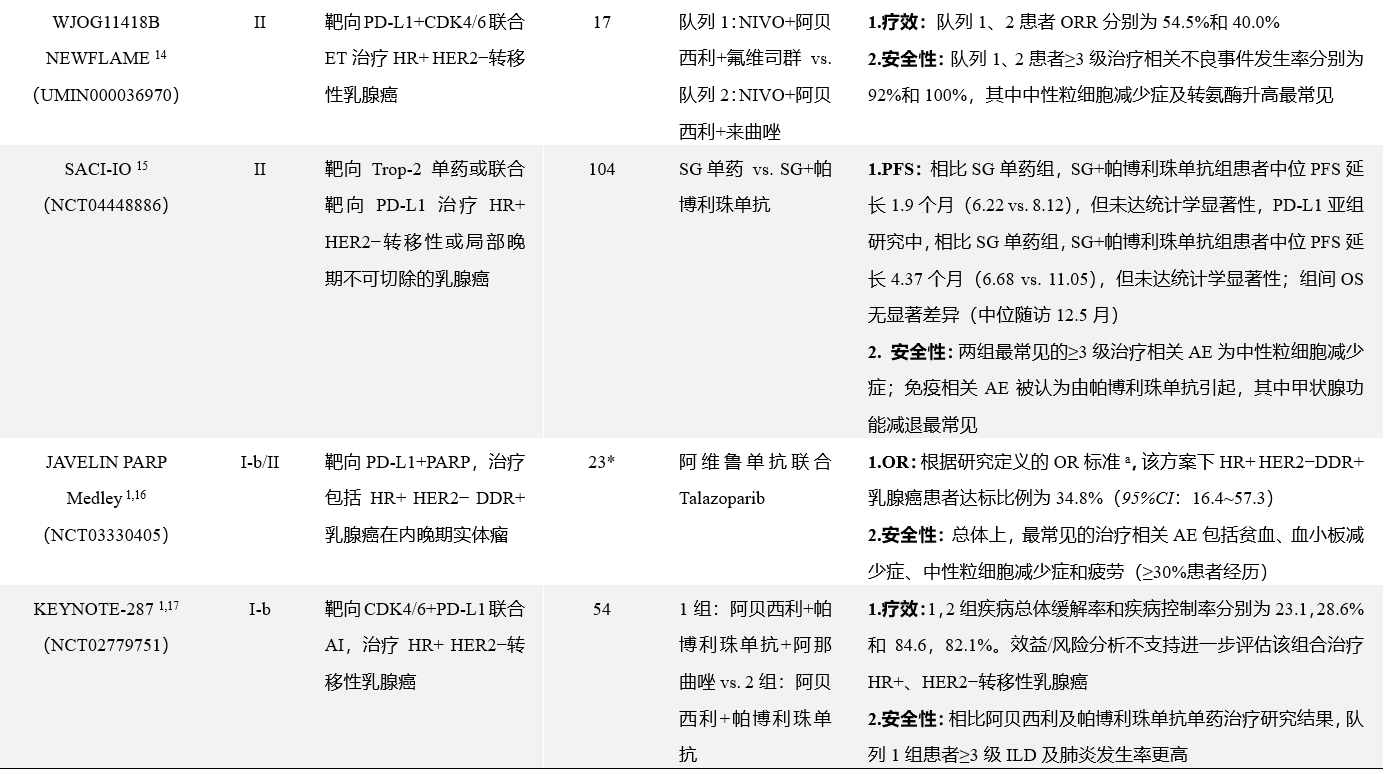
*仅HR+ HER2−DDR+乳腺癌患者;**仅HR+ HER2−乳腺癌患者;仅HR+乳腺癌患者
aOR定义为达到最佳的完全缓解或部分缓解,并在首次记录后≥4周二次评估确认,完全缓解及部分缓解定义参照实体瘤反应评价手册(RECIST 1.1)中的描述
ER:雌激素受体;HER2:人表皮生长因子受体;PD-L1:程序性死亡配体1;pCR:病理完全缓解;PBO:安慰剂;AE:不良事件;NIVO:纳武利尤单抗;NACT:新辅助化疗;ET:内分泌治疗;AD:平均差;OR:比值比;CDK4/6:细胞周期蛋白依赖性激酶4/6;ILD;间质性肺疾病;DDR:DNA损伤反应;PARP:多腺苷二磷酸核糖聚合酶;OR:客观缓解;AI:芳香化酶抑制剂;GnRH-a:促性腺激素释放激素激动剂;RCB:残余肿瘤负荷;PFS:无进展生存期;OS:总生存期;NR:未达统计学边界;SERD:选择性雌激素受体下调剂;ORR:客观缓解率;ADC:抗体药物偶联物;Trop-2:人滋养细胞表面抗原2;Dato-DXd:Datopotamab Deruxtecan,一种靶向Trop-2的ADC类药物;DRD:DNA修复缺陷;Durva:度伐利尤单抗;SG:戈沙妥珠单抗
四、 HR+乳腺癌的免疫治疗的未来发展
在肿瘤免疫治疗广阔的研究格局下,学术界正在将免疫检查点抑制剂(ICI)及其他免疫疗法的应用扩展至除TNBC外的其它肿瘤亚型[3],这对HR+乳腺癌患者而言无疑至关重要。在未来,通过不同手段筛选适用免疫治疗的患者群体,可能助力未来乳腺癌免疫治疗的发展。
通过生物标志物预测免疫治疗效果,可作为筛选适用免疫治疗患者群体的手段。在既往TNBC相关免疫治疗的研究中,已体现出此类疾病在生物标志物方面存在异质性,需更确切地探索TME表征以制定免疫治疗方案[3]。现已开展包括TIL水平、三级淋巴结构及免疫基因表达特征在内多种生物标志物的预测价值研究。但目前仅有程序性死亡配体1(PD-L1)表达相关的免疫组化指标被用于转移性TNBC患者的ICI治疗且尚存争议[3],有必要在未来开展更多研究以明确该指标的预测价值。而血液学生物标志物及液体组织活检也有可能成为监测及预测患者预后的替代方案[3]。
更精确的肿瘤分子分型也有助于筛选适用免疫治疗的患者群体。我国复旦大学研究团队于2023年通过DNA/RNA测序、蛋白及代谢组学数据,应用相似性网络融合(SNF)算法,将HR+HER2-乳腺癌继续细分为SNF1~4四个亚型,并指出不同亚型适合的治疗方案,其中SNF2型更适用免疫疗法[18]。这意味着对HR+乳腺癌而言,更精确的分子分型可能成为免疫治疗发展的另一个方向。此外,I-SPY2研究中基于影像和分子分析结果,预测并筛选免疫治疗后病理完全缓解(pCR)率高的患者群体,这一理念也可能成为未来HR+乳腺癌免疫治疗发展的助力[8-9]。
总结
肿瘤免疫治疗是近年来肿瘤学领域的重要进展,也是乳腺癌治疗的重要手段。HR+乳腺癌作为乳腺癌重要的亚型,其免疫治疗相关研究仍处于探索中。在TME层面,HR+乳腺肿瘤免疫细胞丰度特征复杂,且TME可受雌激素介导的多种通路、内分泌治疗和CDK4/6抑制剂治疗影响。目前学术界已广泛开展HR+乳腺癌治疗相关临床实践研究并取得一定成果。在未来,通过研究具有预测价值的生物标志物,探究更精确的分子分型,以及构建具有预测筛选功能的算法平台,可能有望推动HR+乳腺癌免疫治疗相关研究取得更多突破性成果。
参考文献
- Harris MA, Savas P, Virassamy B, et al. Towards targeting the breast cancer immune microenvironment. Nat Rev Cancer. 2024 Jul 5.
- Miglietta F, Bottosso M, Griguolo G, et al. Major advancements in metastatic breast cancer treatment: when expanding options means prolonging survival. ESMO Open. 2022 Apr;7(2):100409.
- Debien V, De Caluwé A, Wang X, et al. Immunotherapy in breast cancer: an overview of current strategies and perspectives. NPJ Breast Cancer. 2023 Feb 13;9(1):7.
- 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2024[M]. 北京人民卫生出版社, 2024.
- Scirocchi F, Scagnoli S, Botticelli A, et al. Immune effects of CDK4/6 inhibitors in patients with HR+/HER2- metastatic breast cancer: Relief from immunosuppression is associated with clinical response. EBioMedicine. 2022 May;79:104010.
- Cardoso F, McArthur HL, Schmid P, et al. LBA21 KEYNOTE-756: Phase III study of neoadjuvant pembrolizumab (pembro) or placebo (pbo)+ chemotherapy (chemo), followed by adjuvant pembro or pbo+ endocrine therapy (ET) for early-stage high-risk ER+/HER2–breast cancer. Ann Oncol. 2023;34(suppl 2): S1260-S1261.
- Loi, S. et al. LBA20 a randomized, double-blind trial of nivolumab (NIVO) vs placebo (PBO) with neoadjuvant chemotherapy (NACT) followed by adjuvant endocrine therapy (ET) ± NIVO in patients (pts) with high-risk, ER+ HER2− primary breast cancer (BC). Ann. Oncol. 34, S1259–S1260 (2023).
- Jane Lowe Meisel, Katia Khoury, Amy Jo Chien, et al. Rates of pathologic complete response (pCR) after neoadjuvant datopotamab deruxtecan (Dato): Results from the I-SPY2.2 trial. JCO 42, LBA509-LBA509(2024).
- Rebecca Arielle Shatsky, Meghna S. Trivedi, Coral Oghenerukevwe Omene, et al. Rates of pathologic complete response (pCR) after datopotamab deruxtecan (Dato) plus durvalumab (Durva) in the neoadjuvant setting: Results from the I-SPY2.2 trial. JCO 42, LBA501-LBA501(2024).
- Dieci, M. V. et al. Neoadjuvant chemotherapy and immunotherapy in luminal B-like breast cancer: results of the phase II GIADA trial. Clin. Cancer Res. 28, 308–317 (2022).
- Jerusalem G, et al. 92MO Neoadjuvant nivolumab (NIVO) + palbociclib (PALBO) + anastrozole (ANA) for estrogen receptor-positive (ER+)/human epidermal growth factor receptor 2-negative (HER2−) primary breast cancer (BC): CheckMate 7A8. Ann. Oncol. 2022;33:S165–S166.
- Yuan Y, Lee JS, Yost SE, et al. Phase I/II trial of palbociclib, pembrolizumab and letrozole in patients with hormone receptor-positive metastatic breast cancer. Eur J Cancer. 2021 Sep;154:11-20.
- Erica L. Mayer, Yue Ren, et al. GS3-06 Palbociclib After CDK4/6i and Endocrine Therapy (PACE): A Randomized Phase II Study of Fulvestrant, Palbociclib, and Avelumab for Endocrine Pre-treated ER+/HER2- Metastatic Breast Cancer [abstract]. In: Proceedings of the 2022 San Antonio Breast Cancer Symposium; 2022 Dec 6-10; San Antonio, TX. Philadelphia (PA): AACR; Cancer Res 2023;83(5 Suppl):Abstract nr GS3-06.
- Masuda J, Sakai H, Tsurutani J, et al. Efficacy, safety, and biomarker analysis of nivolumab in combination with abemaciclib plus endocrine therapy in patients with HR-positive HER2-negative metastatic breast cancer: a phase II study (WJOG11418B NEWFLAME trial). J Immunother Cancer. 2023 Sep;11(9):e007126.
- Ana Christina Garrido-Castro, Se Eun Kim, Jennifer Desrosiers, et al. SACI-IO HR+: A randomized phase II trial of sacituzumab govitecan with or without pembrolizumab in patients with metastatic hormone receptor-positive/HER2-negative breast cancer. JCO 42, LBA1004-LBA1004(2024).
- Rugo, H. S. et al. Abemaciclib in combination with pembrolizumab for HR+, HER2− metastatic breast cancer: phase 1b study. NPJ Breast Cancer 8, 118 (2022).
- Yap, T. A. et al. Avelumab plus talazoparib in patients with advanced solid tumors: the JAVELIN PARP Medley nonrandomized controlled trial. JAMA Oncol. 9, 40–50 (2023).
- Jin X, Zhou YF, Ma D, et al. Molecular classification of hormone receptor-positive HER2-negative breast cancer. Nat Genet. 2023 Oct;55(10):1696-1708.



