
激素受体(hormonal receptor positive, HR)阳性/人表皮生长因子受体2 (human epidermal growth factor receptor 2 negative, HER-2) 阴性乳腺癌是乳腺癌患者中最常见的亚型,约占每年新发乳腺癌病例的70%。内分泌治疗是HR+乳腺癌重要的治疗手段。近年来,以细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)4/6抑制剂为代表的靶向治疗联合内分泌治疗模式开创了早期及晚期HR+乳腺癌治疗的新格局。同时,抗体药物偶联物(antibody-drug conjugate,ADC)等免疫治疗药物在HR+乳腺癌中的应用也在积极探索中,以期进一步优化治疗,改善患者预后。
1. CDK4/6抑制剂联合内分泌治疗已成为一线治疗标准
在HR+/HER-2-晚期乳腺癌治疗方面,CDK4/6抑制剂联合内分泌治疗已成为一线标准治疗方案,围绕着CDK4/6抑制剂的最佳应用时机、耐药后的治疗选择等仍存在诸多问题。
CDK4/6抑制剂与内分泌治疗协同增效,极大地改善了HR+晚期乳腺癌患者预后,开辟了HR+/HER-2-晚期乳腺癌靶向联合内分泌治疗的新时代。研究证实哌柏西利、阿贝西利、瑞波西利等多个CDK4/6抑制剂可使晚期一线治疗患者的无进展生存期(progression-free survival,PFS)得到显著获益。但PFS获益究竟能否转化为OS获益,始终是临床上持续关注的问题。在哌柏西利、阿贝西利、瑞波西利的系列研究中,只有瑞波西利的MONALEESA研究取得了OS的阳性结果(表1)。在2023年的SABCS上,阿贝西利的MONARCH-3研究也最终公布了其OS结果。
表1 HR+/HER-2-晚期乳腺癌患者治疗的相关临床研究

注:AI为芳香化酶抑制剂;HR+为激素受体阳性;HER-2-为人表皮生长因子受体2阴性;PFS为无进展生存期;CDK为细胞周期依赖性激酶;HR为风险比;95% CI为95%置信区间
MONARCH 3研究是一项随机、双盲、安慰剂对照的3期临床试验,纳入绝经后HR+/HER-2-转移性或局部复发转移性乳腺癌患者,按2:1随机分配接受阿贝西利或安慰剂联合非甾体芳香化酶抑制剂(non-steroidal aromatase inhibitor,NSAI)(阿那曲唑或来曲唑)。最终研究结果显示,在总人群中,阿贝西利联合NSAI一线治疗晚期乳腺癌的中位OS达66.8个月(P=0.066 4),高于安慰剂组的53.7个月(HR=0.804,95%Cl:0.637~1.015,P=0.066 4),但并未达到统计学预设的阈值。
晚期一线治疗是CDK4/6抑制剂联合芳香化酶抑制剂(aromatase inhibitor,AI)还是氟维司群更合适尚无定论。PARSIFAL研究对比了哌柏西利联合氟维司群和哌柏西利联合来曲唑用于内分泌敏感患者一线治疗的疗效,长期随访结果显示无论是在PFS还是OS差异均无统计学意义,联合氟维司群疗效并不优于来曲唑,甚至非劣效也未达到。亚组分析发现,既往CDK4/6抑制剂获益更加明显(PFS≥12个月)的患者,其OS显著延长,明显优于PFS<12个月的患者(81.5个月比24.0个月),这提示临床医师需要筛选CDK4/6抑制剂初治治疗有可能疗效不佳的患者,为这部分人群探索更优的治疗策略。
2. CDK4/6抑制剂是否为一线治疗的唯一选择?
前3种CDK4/6抑制剂临床研究结果振奋人心,这一方案也逐渐成为HR+/HER-2-乳腺癌的标准治疗方案。目前,CDK4/6抑制剂联合AI用于一线治疗的研究和联合氟维司群用于二线治疗的研究都取得了显著性获益,在HR+/HER-2-晚期乳腺癌患者的治疗整体布局中,在二线治疗中使用和在一线治疗中使用是否存在差异也引起了学者的关注。
SONIA研究是一项评估CDK4/6抑制剂作为晚期HR+/HER-2-乳腺癌患者一线/二线治疗方案的随机3期临床试验。研究显示,在37.3个月的中位随访时间中,一线治疗接受CDK4/6抑制剂(一线治疗组)的患者2线后PFS(PFS2)为31.0个月,二线治疗接受CDK4/6抑制剂(二线治疗组)的PFS为26.8个月(HR=0.87,95%Cl:0.74~1.03,P=0.1)。虽然差异无统计学意义,但是2组PFS2的绝对获益达到4.2个月,且SONIA研究的二线治疗组方案为氟维司群单药,可能存在治疗不足的问题,不能代表目前的临床实践。关于CDK4/6 抑制剂的最佳用药方案的确定还需要更多的临床证据。SONIA研究挑战了CDK4/6抑制剂一线使用的地位,认为一线使用CDK4/6抑制剂可能会增加不良反应及患者的经济负担,但国内外指南均建议HR+/HER-2-晚期乳腺癌一线首选 CDK4/6 抑制剂,使患者尽可能早地取得长期生存获益。
3. CDK4/6抑制剂联合PI3K抑制剂一线治疗逆转内分泌耐药
大多数接受晚期一线治疗的患者都是辅助内分泌治疗耐药导致疾病进展,而PI3K信号通路的异常是内分泌治疗耐药的主要机制之一。HR+/HER-2-乳腺癌患者携带的PIK3CA突变可能引起PI3K/AKT/mTOR通路(PAM通路)的异常激活,导致内分泌治疗耐药。对于内分泌治疗耐药患者,CDK4/6抑制剂联合氟维司群是标准治疗方案,但对于PIK3CA基因突变的患者,该方案难以取得令人满意的疗效。INAVO120研究尝试探索新型高选择性PI3K抑制剂Inavolisib联合CDK4/6抑制剂及氟维司群的疗效和安全性,且以CDK4/6抑制剂联合氟维司群作为对照,使研究设计更具临床意义。该研究纳入患者中大约1/3为原发耐药,且多数伴有内脏转移。结果显示,在中位随访21.3 个月时,PI3K 抑制剂 Inavolisib联合氟维司群联合CDK4/6抑制剂能够显著延长患者的 PFS(15.0个月比7.3 个月,HR=0.43,95%CI:0.32~0.59,P<0.0001),并且各亚组获益基本一致。
4. CDK4/6抑制剂治疗疾病进展后的治疗
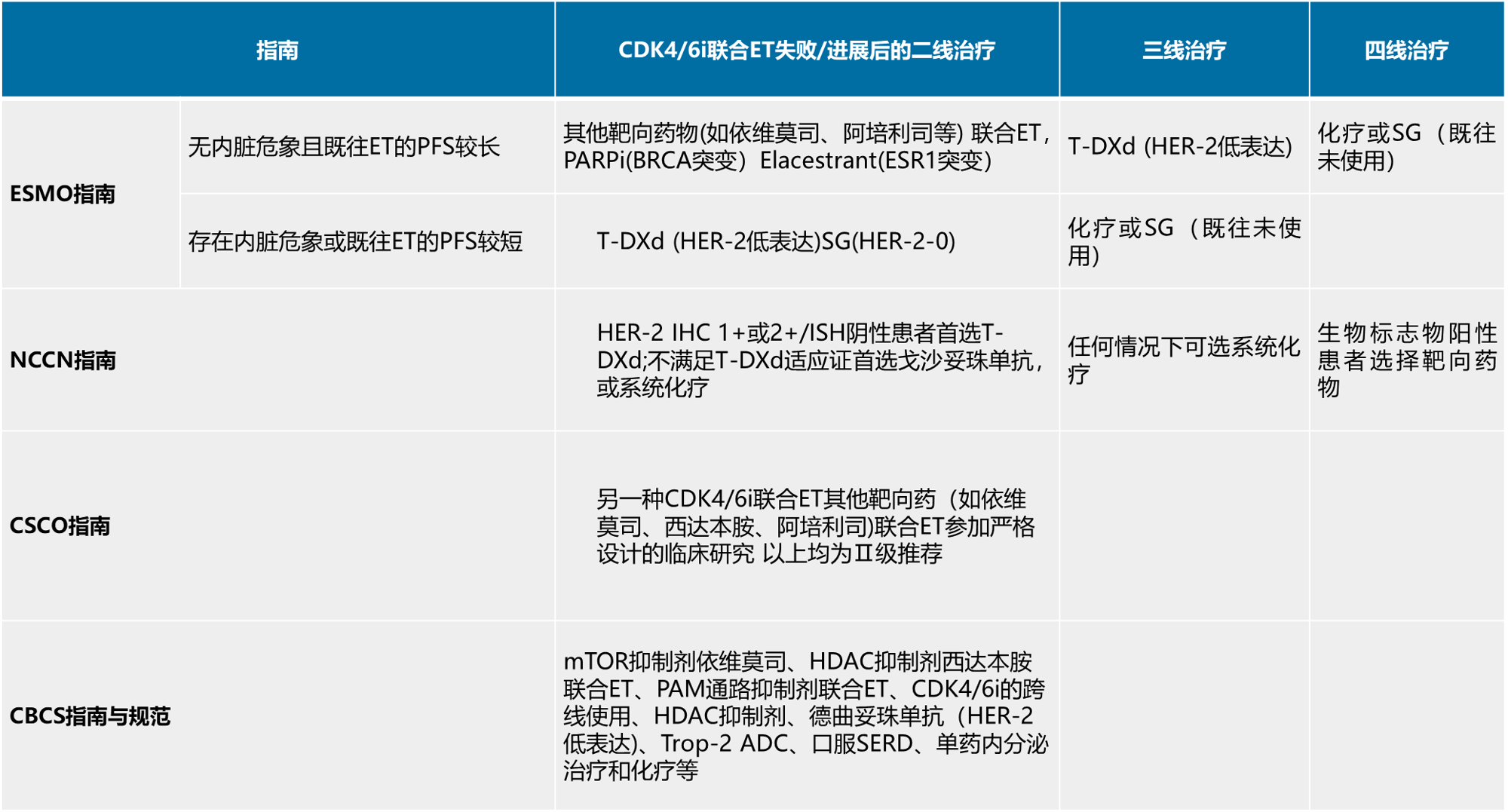
注:CDK4/6i为细胞周期依赖性激酶4/6抑制剂;PARPi为聚腺苷二磷酸核糖聚合酶抑制剂;ET为辅助内分泌治疗; HER-2为人表皮生长因子受体2; PFS为无进展生存期;IHC为免疫组织化学;ISH为原位杂交;mTOR为哺乳动物雷帕霉素靶蛋白;HDAC为组蛋白脱乙酰酶;PAM为PI3K/AKT/mTOR通路;Trop-2为人滋养层细胞表面抗原2;ADC为抗体药物偶联物;SERD为选择性雌激素受体降解药物
对于一线CDK4/6抑制剂联合内分泌治疗后疾病进展的患者,当下国内外指南并无推荐标准治疗方案。2023年更新的ESMO 指南给出了两种策略:对于一线PFS长且无内脏危象的患者,推荐其他靶向药物联合内分泌治疗方案,若再次进展则改用ADC药物治疗;对于内脏危象或CDK4/6抑制剂治疗后快速进展者,直接推荐ADC方案。2024年NCCN指南对于CDK4/6抑制剂联合内分泌治疗进展后并无明确的推荐方案,但对于HR+晚期乳腺癌系统治疗这一主题新增“内脏危象或内分泌难治性乳腺癌”章节,提出了针对该类人群及时转换化疗或ADC药物治疗的建议。
从各指南推荐来看,更换其他靶向联合内分泌方案或者CDK4/6抑制剂的跨线治疗均可作为二线治疗的选择。对于连续两线内分泌联合或不联合向治疗失败的患者,已有专家共识将其定义为内分泌难治性乳腺癌,若进展后继续选择以内分泌为主的治疗方案,获益十分有限。
对于这类患者,新型口服雌激素受体降解剂(selective estrogen receptor degrader,SERD)也有研究进展。EMERALD研究探索了elacestrant对于CDK4/6 抑制剂治疗后进展患者的疗效,入组患者均为既往CDK4/6抑制剂失败的患者,结果显示,elacestrant可显著延长PFS。既往CDK4/6抑制剂治疗的持续时间≥12个月的患者使用elacestrant的PFS获益更显著,这部分患者中ESR1突变患者疗效更好,且不受HER-2表达或TP53突变情况的影响。CAPltello-291研究评估了AKT抑制剂Capivasertib联合氟维司群用于AI耐药患者的疗效,其中约69%的患者既往CDK4/6抑制剂治疗失败。研究结果显示,无论AKT通路是否改变,Capivasertib联合氟维司群均能给患者带来一致的PFS获益。
此外,新型ADC药物也在HR+/HER-2-晚期乳腺癌内分泌耐药人群中展现了良好的疗效,尤其是在CDK4/6抑制剂经治患者中对比化疗,新型的ADC药物均显著优于传统化疗药物。Dato-DXd是一款靶向Trop2的ADC药物。TROPION-BREAST01研究是Dato-DXd在乳腺癌领域的首个3期研究,入组HR+/HER-2-晚期乳腺癌患者,患者经历过一、二线化疗,且之前经历过内分泌治疗或者判断为不适合内分泌治疗。研究结果显示,主要终点PFS从研究者选择的单药化疗组(ICC组)的4.9个月,提升至Dato-DXd组的6.9个月(HR=0.63,P<0.0001),Dato-DXd将患者的疾病进展率降低37%。安全性方面,与ICC相比,接受Dato-DXd治疗的患者发生≥3级治疗相关不良反应的情况较少,中断/减少剂量的情况较少。
传统分子病理学中的HER-2阴性人群既包括免疫组织化学(immunohistochemistry, IHC)0,也包括IHC(+)和IHC(2+)且FISH阴性。流行病学数据显示,在HR阳性人群中有50%~60%的患者存在HER-2低表达,提示有很大一部分HR阳性晚期乳腺癌患者能够从新型ADC治疗中获益。T-DXd(DS8201)是一款靶向HER-2的ADC药物。DESTINY-BREAST04研究纳入HER-2低表达晚期乳腺癌患者,按2:1随机分为德曲妥珠单抗组(T-DXd组,373例)和医师选择的化疗组(TPC组,184例),其中HR阳性、HER-2低表达晚期乳腺癌患者共494例(T-DXd 组331例,TPC组163例)。结果显示HR阳性乳腺癌人群中,T-DXd 组较TPC组中位PFS(9.6个月比 4.2个月)和中位OS(23.9个月比17.5个月)均有临床和统计学的显著改善。
结语
对于CDK4/6抑制剂经治后失败的晚期 HR+/HER-2-乳腺癌患者,多种ADC药物对比化疗优势显著,但是针对不同靶点的ADC药物如何选择、ADC换药后的疗效及毒性累积仍有待研究。此外,新型靶向药物PI3K抑制剂、AKT抑制剂、新型口服SERD药物等联合治疗也有极大的潜力。期待在不久的将来,乳腺癌的治疗将越来越精准而有效,为早期患者带来更多的治愈和更小的创伤,为晚期患者提供更多有效延长生命和改善生活质量的治疗选择。
参考文献
- 梁旭, 宋国红. 2023年激素受体阳性/HER-2阴性乳腺癌治疗的研究进展[J]. 中华乳腺病杂志(电子版), 2024, 18(02): 71-77.



