
简要介绍
前列腺癌
1. Nat Commun:转移性去势抵抗性前列腺癌患者中提示雄激素受体变异的循环肿瘤脱氧核糖核酸检测
2. J Clin Oncol:针对主动监测中的前列腺癌男性患者采用富含 Omega - 3、低 Omega - 6 饮食并补充鱼油的干预:CAPFISH - 3 随机临床试验
3. Nature:前列腺癌中髓系细胞介导的免疫治疗耐药的演变
肾癌
4. Lancet Oncol:贝组替凡联合卡博替尼作为晚期透明细胞肾细胞癌患者的一线治疗(LITESPARK - 003):一项开放标签、单臂 II 期研究
5. Ann Oncol:Avelumab + 阿昔替尼对比舒尼替尼作为晚期肾细胞癌患者的一线治疗:3 期 JAVELIN Renal 101 试验的最终分析
6. Lancet:Tivozanib 联合纳武利尤单抗对比 Tivozanib 单药治疗经免疫检查点抑制剂治疗的肾细胞癌患者:III 期 TiNivo - 2 研究结果
7. JAMA Oncol:为免疫治疗的改良分类而进行的疾病进展模式解析
前列腺癌
1. 转移性去势抵抗性前列腺癌患者中提示雄激素受体变异的循环肿瘤脱氧核糖核酸检测
发表期刊:Nat Commun
背景:癌症患者血浆游离脱氧核糖核酸(cfDNA)中的循环肿瘤脱氧核糖核酸(ctDNA)与预后不良相关,但要从少量血浆中检测出 ctDNA 颇具挑战。在转移性去势抵抗性前列腺癌(mCRPC)中,需要通过 ctDNA 检测来预测接受雄激素受体(AR)抑制剂治疗患者的预后情况。
目的:我们开发了一种定制的靶向 cfDNA 测序检测方法,名为 AR - ctDETECT,用于在“Alliance A031201”随机 III 期试验中,从 mCRPC 患者有限的血浆 cfDNA 中检测 ctDNA,该试验研究的是恩杂鲁胺联合或不联合阿比特龙的疗效。
结果:在 776 名患者中,59%的患者 ctDNA 呈阳性,其中26%的患者 ctDNA 非整倍性程度高,33%的患者 ctDNA 非整倍性程度低但存在AR扩增或结构重排、MYC/MYCN扩增或致病性突变。ctDNA 阳性患者的中位总生存期明显短于 ctDNA 阴性患者(分别为 29.0 个月和 47.4 个月,见下图)。
结论:结果表明,使用 AR - ctDETECT 检测方法确定为 ctDNA 阳性的 mCRPC 患者,即便使用强效 AR 抑制剂进行治疗,生存期仍然较短。
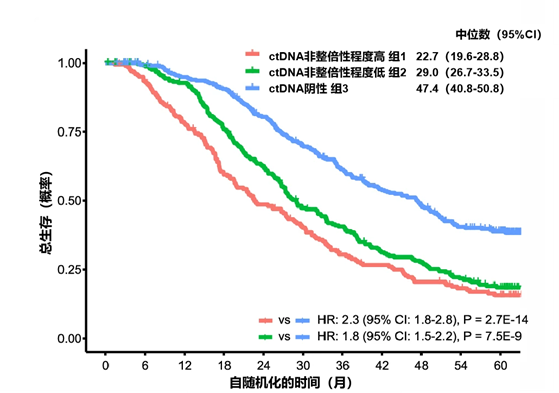
图1:各组患者的总生存
2. 针对主动监测中的前列腺癌男性患者采用富含 Omega - 3、低 Omega - 6 饮食并补充鱼油的干预:CAPFISH - 3 随机临床试验
发表期刊:J Clin Oncol
目的:接受前列腺癌主动监测(AS)的前列腺癌患者对通过改变饮食或服用补充剂来预防疾病进展极为关注。我们旨在探究,在为期 1 年的时间里,采用富含 ω - 3 脂肪酸、低 ω - 6 脂肪酸的饮食并搭配鱼油胶囊,是否能降低接受主动监测的前列腺癌患者前列腺活检组织中的细胞增殖(Ki - 67 指标)。
方法:在这项 II 期前瞻性随机试验中,100 名选择主动监测的 1 级或 2 级前列腺癌患者,被随机分配至 D + FO 组(富含 Omega - 3、低 Omega - 6 饮食并补充鱼油组)或对照组。在基线期和 1 年后,在同一部位进行前列腺活检。主要终点是比较两组从基线期到 1 年后,同一部位活检组织中 Ki - 67 指数的变化。
结果:D + FO 组的 Ki - 67 指数从基线期到 1 年后下降了约 15%(基线期为 1.34%,1 年后为 1.14%,图 2A),而对照组从基线期到 1 年后上升了约 24%(基线期为1.23%,1 年后为 1.52%,图 2A),两组间 Ki - 67 指数的变化存在统计学显著差异(95% CI为 2% - 52%,P = 0.043,图 2B)。两组在次要结局指标,如分级分组、肿瘤长度、Decipher 基因组评分或前列腺特异性抗原上均无显著差异。D + FO 组有 4 名患者因与鱼油相关的不良事件而退出试验。
结论:为期 1 年的富含 ω - 3 脂肪酸、低 ω - 6 脂肪酸的饮食并搭配鱼油,显著降低了 Ki - 67指数(一个与前列腺癌进展、转移和死亡相关的生物标志物)。这些结果为未来在接受主动监测的患者中开展包含此干预措施的 III 期试验提供了支持。
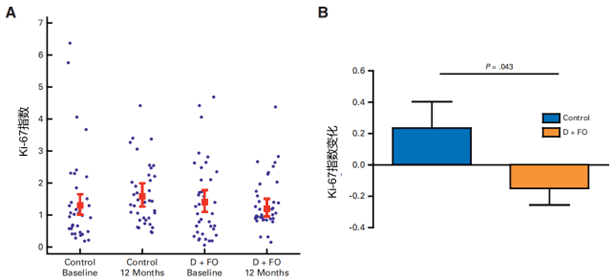
图2:通过多重荧光染色检测基线和 12 个月时前列腺同部位活检的 Ki-67 指数
3. 前列腺癌中髓系细胞介导的免疫治疗耐药的演变
发表期刊:Nature
背景:前列腺癌是全球男性常见恶性肿瘤,早期雄激素剥夺治疗有效,但多数患者会发展为转移性去势抵抗性前列腺癌(mCRPC),此时肿瘤耐药且治疗选择有限,预后差。mCRPC 患者对免疫检查点抑制剂(ICIs)应答普遍不佳,这主要因为肿瘤微环境存在免疫抑制性髓系细胞,且在雄激素剥夺治疗后进一步富集,形成免疫屏障。针对髓系细胞的集落刺激因子 1 受体(CSF1R)阻断剂临床试验效果不佳,反映了髓系细胞种群的异质性和复杂免疫调控网络。
研究发现:研究人员通过单细胞 RNA 测序对前列腺癌患者肿瘤样本分析,发现高度表达 SPP1 基因的肿瘤相关巨噬细胞(SPP1hi - TAMs)是免疫治疗耐药的关键。其在mCRPC 患者肿瘤微环境中显著富集,数量增加且免疫抑制功能强。体外和体内实验表明,SPP1hi - TAMs 通过腺苷信号通路抑制 CD8+ T 细胞增殖和功能,是 ICIs 耐药关键因素。而腺苷 A2A 受体(A2AR)阻断剂 ciforadenant 可降低其免疫抑制作用,增强 CD8+ T 细胞抗肿瘤活性,联合 ICIs 可抑制肿瘤生长、延长小鼠生存期。小鼠模型和早期临床试验显示,A2AR 抑制剂与免疫检查点抑制剂联合使用,可有效抑制肿瘤生长,部分患者前列腺特异性抗原水平显著下降、肿瘤体积缩小。
展望:未来,SPP1hi - TAMs 可作为生物标志物预测免疫治疗效果,帮助筛选更可能受益于联合治疗的患者,实现个性化治疗。其本身也是潜在治疗靶点,未来可探索更多抑制其功能或减少数量的方法。
肾癌
4. 贝组替凡联合卡博替尼作为晚期透明细胞肾细胞癌患者的一线治疗(LITESPARK - 003):一项开放标签、单臂II期研究
发表期刊:Lancet Oncol
背景:贝组替凡作为首款缺氧诱导因子 - 2α(HIF - 2α)抑制剂,无论是单药治疗,还是与卡博替尼联合用于既往接受过治疗的晚期肾癌患者,均已显示出抗肿瘤活性。II 期 LITESPARK - 003 研究旨在确定贝组替凡联合卡博替尼,用于既往未接受过治疗(队列 1)或既往接受过免疫治疗(队列 2)的晚期透明细胞肾细胞癌患者时的有效性及安全性。在此,我们报告该临床试验队列 1 的结果。
方法:LITESPARK - 003 是一项在美国 10 家医院及癌症中心开展的开放标签、单臂 II 期研究。在队列 1 中,符合条件的患者年龄需至少 18 岁,东部肿瘤协作组体能状态评分为 0 或 1,且既往未接受过针对局部晚期或转移性肾细胞癌全身系统性治疗。患者每日口服 120 毫克贝组替凡和 60 毫克卡博替尼各一次,直至出现无法耐受的不良事件、疾病进展或患者退出。主要终点为由研究者评估确认的客观缓解情况(根据实体瘤疗效评价标准 1.1 版)。对所有接受至少一剂研究治疗的患者进行抗肿瘤活性及安全性评估。本试验已在 ClinicalTrials.gov 注册,编号 NCT03634540,目前仍在进行中。
结果:在 2018 年 9 月 27 日至 2023 年 1 月 10 日期间,我们筛选了 138 例患者进行了入组,其中 50 例(36%)患者入组并被分配至队列 1。患者中位年龄为 64 岁(四分位间距为 57 - 72 岁)。50 例患者中,40 例(80%)为男性,10 例(20%)为女性。48 例(96%)患者为白人,1 例(2%)为黑人或非裔美国人,1 例(2%)属于其他种族类别。截至数据截止日期(2023 年 5 月 15 日),中位随访时间为 24.3 个月(四分位间距为 13.9 - 32.0 个月)。如图 3 所示,50 例患者中有 35 例(70%,95% CI为 55 - 82)获得确认的客观缓解,其中 4 例(8%)为完全缓解,31 例(62%)为部分缓解。最常见的 3 - 4 级治疗相关不良事件为高血压(6 例[12%]患者)、贫血(5 例[10%]患者)和疲劳(4 例[8%]患者)。50 例患者中有 7 例(14%)发生严重的治疗相关不良事件。未发生与治疗相关的死亡事件。
结论:贝组替凡联合卡博替尼对初治的晚期透明细胞肾细胞癌患者具有良好的抗肿瘤活性,有必要进一步研究 HIF - 2α 抑制剂联合多靶点酪氨酸激酶抑制剂作为治疗选择用于初治的晚期透明细胞肾细胞癌患者。

图3:反应时间和反应持续时间
5. Avelumab + 阿昔替尼对比舒尼替尼作为晚期肾细胞癌患者的一线治疗:3 期 JAVELIN Renal 101 试验的最终分析
发表期刊:Ann Oncol.
背景:在 III 期 JAVELIN Renal 101 试验(NCT02684006)中,对于晚期肾细胞癌(aRCC)患者,一线使用 Avelumab 联合阿昔替尼治疗,与舒尼替尼相比,可显著延长无进展生存期(PFS),并提高客观缓解率(ORR)。我们在此报告最终分析结果,包括总生存期(OS)的主要分析。
患者与方法:招募未经治疗的 aRCC 患者(任何预后风险评分)。主要终点为程序性死亡配体 1 阳性(PD - L1 +)人群的 OS 和 PFS。同时评估 ORR、缓解持续时间(DOR)、安全性和患者报告结局(PROs)。
结果:所有患者的最短随访时间为 68 个月。如表 1 所示,在 PD - L1 + 人群中,Avelumab 联合阿昔替尼与舒尼替尼的中位 OS(95% CI)分别为 43.2(36.5 - 51.7)个月和 36.2(29.8 - 44.2)个月(风险比[HR],0.86 [95% CI,0.701 - 1.057];P = 0.0755);在总体人群中,分别为 44.8(39.7 - 51.1)个月和 38.9(31.4 - 45.2)个月(HR=0.88 [95% CI,0.749 - 1.039];P = 0.0669)。与舒尼替尼相比,Avelumab 联合阿昔替尼研究者评估的 PFS 仍有延长(总体人群 5 年 PFS 率[95% CI],12.0% [8.9% - 15.6%]对比 4.4% [2.5% - 7.3%])。总体人群中,Avelumab 联合阿昔替尼的 ORR(95% CI)为 59.7%(55.0% - 64.3%),舒尼替尼为 32.0%(27.7% - 36.5%);DOR(95% CI)≥5年的比例两组分别为 16.4%(12.0% - 21.4%)和 9.2%(4.6% - 15.7%)。≥3 级治疗相关不良事件发生率分别为 66.8% 和61.5%。两组的 PROs 相似。
结论:JAVELIN Renal 101 试验提供了目前3期试验中针对 aRCC 的免疫检查点抑制剂联合酪氨酸激酶抑制剂治疗最长时间的随访数据。OS 分析显示,Avelumab 联合阿昔替尼相较于舒尼替尼更具优势,但未达到统计学显著性;后续治疗可能对结果产生了影响。与舒尼替尼相比,Avelumab 联合阿昔替尼具有长期疗效优势,包括延长 PFS、ORR 几乎翻倍以及更持久的缓解,且长期安全性可控。
表1:PD-L1+ 人群和总体人群中每个研究者评估的应答总结

6. Tivozanib 联合纳武利尤单抗对比 Tivozanib 单药治疗经免疫检查点抑制剂治疗的肾细胞癌患者:III 期 TiNivo - 2 研究结果
发表期刊:Lancet
背景:免疫检查点抑制剂(ICIs)和血管内皮生长因子受体酪氨酸激酶抑制剂是晚期肾细胞癌一线治疗的基石。然而,疾病进展后的最佳治疗顺序尚不明确。本研究旨在评估在接受过一到两线 ICI 后治疗进展的转移性肾细胞癌患者中,Tivozanib 联合纳武利尤单抗对比 Tivozanib 单药治疗的临床疗效。
方法:TiNivo - 2 是一项多中心、随机、开放标签的 III 期试验,在澳大利亚、欧洲、北美洲和南美洲 16 个国家的 190 个研究中心开展。患有晚期肾细胞癌且在之前一到两线治疗(包括一线 ICI)期间或之后出现疾病进展的患者,按 1 : 1 随机分配到接受 Tivozanib(每日0.89毫克,口服)联合纳武利尤单抗(每4周480毫克,静脉注射)或 Tivozanib(每日1.34毫克,口服)治疗。随机分组根据前线治疗(ICI 或非 ICI)以及国际转移性肾细胞癌数据库联盟风险类别进行分层。主要终点为无进展生存期(PFS),定义为从随机分组至首次记录到客观疾病进展(依据实体瘤疗效评价标准 1.1 版,由独立影像学评估)或任何原因导致的死亡(以先发生者为准)的时间。在意向性治疗人群中评估疗效,在接受一剂或多剂研究药物的患者中评估安全性。本试验已在 ClinicalTrials.gov 注册(NCT04987203),目前处于进行中但不再招募患者。
结果:2021 年 11 月 4 日至 2023 年 6 月 16 日,343 例患者被随机分配至 Tivozanib 联合纳武利尤单抗组(n = 171)或 Tivozanib 单药治疗组(n = 172)。中位随访时间为 12.0 个月。Tivozanib 联合纳武利尤单抗组的中位 PFS 为5.7个月(95% CI,4.0 - 7.4),Tivozanib 单药治疗组为 7.4 个月(5.6 - 9.2)(HR=1.10,95% CI,0.84 - 1.43;P = 0.49),见图 4。在上一线治疗为 ICI 的患者(n = 244)中,Tivozanib 联合纳武利尤单抗组的中位 PFS 为 7.4 个月(95% CI,5.6 - 9.6),Tivozanib 单药治疗组为9.2个月(7.4 - 10.0)。在上一线治疗为非 ICI 的患者中,观察到中位 PFS 较低,且两组间无差异(Tivozanib 联合纳武利尤单抗组 3.7 个月[95% CI,2.7 - 5.4],Tivozanib 单药治疗组 3.7 个月[1.9 - 7.2])。接受 Tivozanib 联合纳武利尤单抗治疗的 168 例患者中有 54 例(32%)发生严重不良事件,接受 Tivozanib 单药治疗的 171 例患者中有 64 例(37%)发生严重不良事件。发生 1 例(<1%)与治疗相关的死亡(Tivozanib 组)。
结论:这些数据进一步支持不建议对晚期肾细胞癌患者再次使用 ICI。此外,这些数据表明 Tivozanib 单药治疗在 ICI 经治的患者中具有疗效。
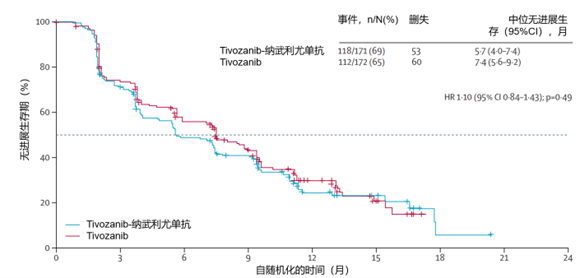
图4:意向治疗人群无进展生存期 Kaplan-Meier 估计
7. 为免疫治疗的改良分类而进行的疾病进展模式解析
发表期刊:JAMA Oncol
重要性:根据实体瘤疗效评价标准(RECIST)1.1 版,接受免疫检查点抑制剂(ICI)治疗的患者,其疾病进展(PD)的结局差异很大。为使 RECIST 适用于 ICI 治疗而做出的改进,并未解决 PD 模式的异质性问题,这给临床带来了挑战。
目的:基于 PD 模式制定并验证一种改良的 PD 分类方法,评估其与接受程序性细胞死亡蛋白配体 1 抗体阿替利珠单抗治疗的多种实体瘤患者的进展后生存期(PPOS)之间的关系。
研究设计、研究环境与研究对象:本研究分析了 5 项 III 期试验(IMmotion151、IMvigor211、OAK、Impower133和IMspire150)的数据,涉及接受阿替利珠单抗治疗的肾细胞癌(RCC)、尿路上皮癌、小细胞肺癌、非小细胞肺癌和黑色素瘤患者。这项事后分析于 2024 年 3 月至 9 月进行。
暴露因素:接受阿替利珠单抗治疗。
主要结局与测量指标:主要结局是 PD 模式与 PPOS 的关联。根据靶病灶和非靶病灶的增大情况或新病灶及其组合,确定了 7 种 PD 模式。
结果:5 项试验共分析了 1377 例患者。在肾细胞癌患者中,7 种 PD 模式对预后有显著影响。6 个月 PPOS 概率从靶病灶和非靶病灶进展且出现新病灶的26%到仅靶病灶或非靶病灶进展的90%不等。由此制定了一种改良的 PD 分类方法,将 PD 分为 3 个风险等级:低风险(现有病灶进展)、中风险(出现新病灶但现有病灶无进展)和高风险(现有病灶进展且出现新病灶)。如图 5,使用改良的PD分类模型分类后,12 个月 PPOS 范围从高风险 PD 组的22%(95% CI, 10%-47%)到低风险PD组的74%(95% CI, 65%-86%)。在接受ICI治疗的肾细胞癌患者中,该评分与 PPOS 相关,与高风险 PD 相比,低风险和中风险 PD 的 HR 分别为 0.23(95% CI,0.13 - 0.41;P <.001)和0.39(95% CI,0.23 - 0.66;P <.001)。在其他试验中证实了该评分在多种肿瘤中的适用性。
结论与意义:在本研究中,基于 PD 模式制定了一种生存评分。这种风险分类与接受免疫治疗的多种实体瘤患者的 PPOS 相关,因此可能会提高预测能力和临床决策水平,有望为接受免疫治疗且出现 PD 的患者提供一种有价值的工具。
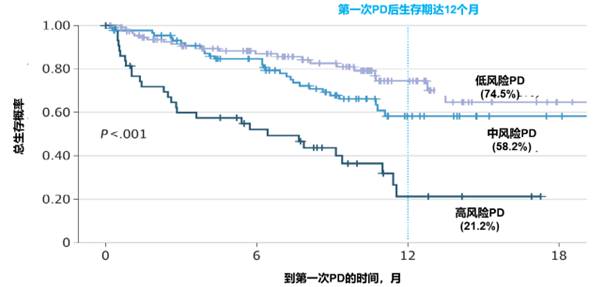
图5:修改后的 PD 分类与 PPOS 相关
参考文献:
[1] Knutson TP, Luo B, Kobilka A, et al. AR alterations inform circulating tumor DNA detection in metastatic castration resistant prostate cancer patients [J]. Nat Commun, 2024,15(1):10648.
[2] Aronson WJ, Grogan T, Liang P, et al. High Omega-3, Low Omega-6 Diet With Fish Oil for Men With Prostate Cancer on Active Surveillance: The CAPFISH-3 Randomized Clinical Trial [J]. J Clin Oncol. 2024 Dec 13
[3] Lyu A, Fan Z, Clark M, et al. Evolution of myeloid-mediated immunotherapy resistance in prostate cancer [J]. Nature. 2024 Dec 4.
[4] Choueiri TK, Merchan JR, Figlin R, et al. Belzutifan plus cabozantinib as first-line treatment for patients with advanced clear-cell renal cell carcinoma (LITESPARK-003): an open-label, single-arm, phase 2 study. Lancet Oncol [J]. 2025,26(1):64-73.
[5] Choueiri TK, Penkov K, Uemura H, et al. Avelumab + axitinib vs sunitinib as first-line treatment for patients with advanced renal cell carcinoma: final analysis of the phase 3 JAVELIN Renal 101 trial [J]. Ann Oncol. 2024 ,18:S0923-7534(24)04987-1.
[6] Choueiri TK, Albiges L, Barthélémy P, et al. Tivozanib plus nivolumab versus tivozanib monotherapy in patients with renal cell carcinoma following an immune checkpoint inhibitor: results of the phase 3 TiNivo-2 Study [J]. Lancet. 2024 ,404(10460):1309-1320.
[7] Saal J, Eckstein M, Ritter M, et al. Dissection of Progressive Disease Patterns for a Modified Classification for Immunotherapy [J]. JAMA Oncol. Dec 26.



