
简要介绍
前列腺癌
1. Lancet Oncol:雄激素剥夺治疗联合立体定向体部放射治疗与单纯 SBRT 治疗激素敏感性寡复发前列腺癌的对比(RADIOSA):一项随机、开放标签的 II 期临床试验
2. Lancet Oncol:转移性去势抵抗性前列腺癌中[177Lu]Lu-PSMA-617 联合恩扎卢胺对比恩扎卢胺单药的总生存期与生活质量(ENZA-p):一项多中心、开放标签、随机 II 期试验的次要终点
3. JAMA Oncol:前列腺癌患者血浆雄激素受体变化与强化激素治疗的时机选择:STAMPEDE 3 期随机临床试验
4. Eur Urol:局部晚期和转移性激素敏感性前列腺癌的联合治疗
5. Eur Urol:恩扎卢胺对生化复发前列腺癌患者性活动的影响:EMBARK 研究患者报告结局的事后分析
6. Ann Oncol:预测前列腺癌放疗剂量反应:III 期随机临床试验 NRG/RTOG 0126和SAKK 09/10 中辐射特征的验证
7. Cancer Discov:雄激素受体抑制上调 MHC I 类表达并增强前列腺癌免疫应答
肾癌
8. Nature:一种新抗原疫苗在肾细胞癌中诱导抗肿瘤免疫
9. Cancer Discov:三级淋巴结构及耗竭性组织驻留T细胞决定肾细胞癌对 PD-1 抑制剂的临床反应
10. Nat Cancer:肾细胞癌免疫检查点抑制剂“超常反应”的免疫基因组决定因素
前列腺癌
1.雄激素剥夺治疗联合立体定向体部放射治疗与单纯 SBRT 治疗激素敏感性寡复发前列腺癌的对比(RADIOSA):一项随机、开放标签的 II 期临床试验
发表期刊:Lancet Oncol
背景:在寡转移前列腺癌患者中,立体定向放疗(SBRT)为基础的转移灶定向治疗已被证实可改善临床结局。本研究旨在探讨:对于异时性寡复发性激素敏感性前列腺癌患者,在所有寡转移灶处联合应用短期雄激素剥夺治疗(ADT)与 SBRT,相比单纯 SBRT 是否能延长临床无进展生存期。
方法:RADIOSA 研究是在意大利米兰欧洲肿瘤研究所开展的一项单中心、随机、开放标签、对照Ⅱ期临床试验。主要纳入标准为:组织学确诊的前列腺癌初诊患者,根治性局部前列腺治疗后出现生化进展或盆腔淋巴结复发、区域外淋巴结复发或经新一代影像学检查发现最多3个骨转移灶的前列腺癌;东部肿瘤协作组(ECOG)体能状态评分 0-1 分;年龄≥18 岁。根据前列腺特异性膜抗原倍增时间(≤3 个月vs>3个月)、转移灶定位(淋巴结vs骨)及诊断影像学方法(正电子发射断层扫描vs MRI)进行分层,采用计算机生成随机数字将患者按 1:1 随机分配接受单纯 SBRT 或 SBRT 联合 6 个月 ADT。SBRT 治疗方案为每两天一次分三次给予 30 Gy(等效 2 Gy 分割剂量为 98.6 Gy,α/β 比值取 1.5 Gy,生物有效剂量>100Gy),或根据病灶位置调整等效方案。SBRT 联合 ADT 组患者在 SBRT 开始前 1 周内接受 6 个月黄体生成素释放激素类似物治疗。治疗分配未设盲。主要终点为临床无进展生存期。所有分析遵循改良意向治疗原则,纳入分配至治疗组且有可用数据的患者。本试验已在 ClinicalTrials.gov 注册(NCT02680587),现已完成。
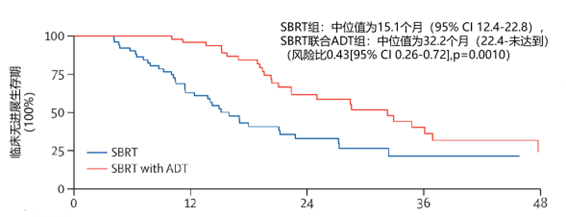
结果:2019 年 8 月 1 日至 2023 年 4 月 30 日期间,218 例患者接受筛选,113 例被排除,105 例入组并随机分配接受治疗(单纯 SBRT 组 52 例,SBRT 联合 ADT 组 53 例)。3 例患者失访,每组各 51 例纳入主要终点分析。入组时中位年龄 70 岁(IQR 65-75);未收集种族和民族数据。两组中位随访时间均为 31 个月(IQR 16-36),如图 1,单纯 SBRT 组中位临床无进展生存期为 15.1 个月(95% CI 12.4-22.8),SBRT 联合 ADT 组中位临床无进展生存期为 32.2 个月(22.4-未达到)(风险比 0.43[95% CI 0.26-0.72],p=0.0010)。报告 1 例胃肠道 1 级不良事件(SBRT组)和 1 例泌尿生殖系统3级不良事件(左输尿管狭窄,SBRT 联合 ADT 组),未观察到晚期毒性反应。22 例 ADT 相关 1 级不良事件均在末次随访时缓解。无治疗相关死亡病例。
结论:据我们所知,RADIOSA 试验是第一项在异时性寡转移激素敏感性前列腺癌中证实 SBRT 联合短期 ADT 可改善临床无进展生存期的随机试验,尽管经严格筛选的患者仍可能从单纯 SBRT 中获益。本研究通过证实临床无进展生存期的改善,强化了转移灶定向治疗在延缓系统治疗的作用。此外,研究强调需要进一步研究确定 ADT 的最佳持续时间,并识别预测单纯 SBRT 疗效的生物标志物。
图 1.SBRT 及 SBRT 联合 ADT 组临床无进展生存期
2.转移性去势抵抗性前列腺癌中 [177Lu]Lu-PSMA-617 联合恩扎卢胺对比恩扎卢胺单药的总生存期与生活质量(ENZA-p):一项多中心、开放标签、随机II期试验的次要终点
发表期刊:Lancet Oncol
背景:ENZA-p 试验的中期分析显示,在转移性去势抵抗性前列腺癌(mCRPC)的一线治疗中,将镥-177 [¹⁷⁷Lu]Lu-前列腺特异性膜抗原(PSMA)-617 联合恩扎卢胺可改善前列腺特异性抗原(PSA)无进展生存期。本文报告延长随访后的次要终点——总生存期(OS)和健康相关生活质量(HRQOL)结果。
方法:ENZA-p 是一项在澳大利亚 15 家医院开展的多中心、开放标签、随机II期试验。入组标准包括:18 岁及以上未经多西他赛或雄激素受体通路抑制剂治疗的 mCRPC 患者,镓-68 [68Ga]Ga PSMA-PET-CT 阳性病灶,东部肿瘤协作组(ECOG)体能状态 0-2 分,且具有至少两项恩扎卢胺早期进展风险因素。患者通过中央随机系统(含最小化法和随机成分)按研究中心、肿瘤负荷、早期多西他赛使用史及阿比特龙治疗史分层,1:1 分配至恩扎卢胺单药组(160 mg/日口服)或联合组(恩扎卢胺+适应性剂量 [2或4剂] ¹⁷⁷Lu-PSMA-617 静脉注射,每 6 - 8 周 7.5 GBq)。主要终点为 PSA 无进展生存期(已发表),次要终点包括总生存期(定义为随机化至全因死亡或末次存活确认的时间)和 HRQOL 。HRQOL 采用 EORTC QLQ-C30 量表和患者疾病治疗评估表评估,以“无恶化生存期”(定义为随机化至首次出现死亡、临床进展、终止治疗,或躯体功能/总体健康及生活质量评分较基线下降≥ 10 分的时间)衡量。所有分析均基于意向治疗人群,试验注册于 ClinicalTrials.gov(NCT04419402),随访已完成。
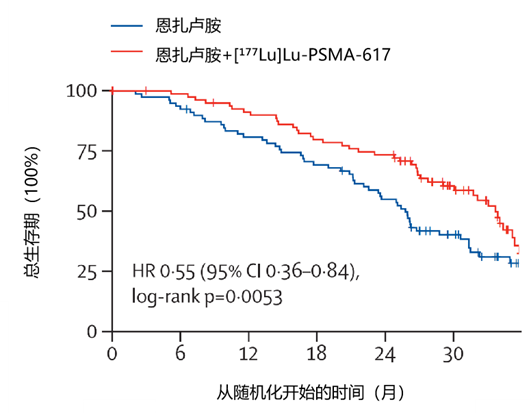
结果:2020 年 8 月 17 日至 2022 年7 月 26 日期间,79 例患者分入恩扎卢胺组,83 例分入联合组。中位随访 34 个月(IQR 29-39)后,共记录 96 例死亡(恩扎卢胺组 53 例[67%] vs 联合组 43 例[52%])。联合组总生存期显著优于单药组(中位 34 个月[95% CI 30-37] vs 26 个月[23-31],HR=0.55[0.36-0.84],见图2)。162 例患者中 154 例(95%)完成 HRQOL 评估。联合组在 12 个月无恶化生存率及分层 log-rank p 值优于单药组:躯体功能:中位 10.64 个月[7.66-12.42] vs 3.42 个月[3.19-7.89],HR=0.51[0.36-0.72],p<0.0001。总体健康及生活质量:中位 8.71 个月[6.41-11.56] vs 3.32 个月[3.09-5.26],HR=0.47[0.33-0.67],p=0.0001。联合组在进展前的疼痛评分(差异7.3[1.6-12.9], p=0.012)和疲劳评分(差异5.9 [1.1-10.7], p=0.016)亦更优。自评口干发生率单药组低于联合组(57% vs 74%,p=0.039),其余部分无显著差异。安全性方面,3-5级不良事件发生率相似(单药组44% vs 联合组46%),无治疗相关死亡。
总结:对于高风险 mCRPC 患者,恩扎卢胺联合 [¹⁷⁷Lu]Lu-PSMA-617 可改善生存及部分 HRQOL 指标。该结果支持开展III期研究,评估适应性剂量 [¹⁷⁷Lu]Lu-PSMA-617 联合雄激素受体通路抑制剂在转移性前列腺癌中的价值。
图2.恩扎卢胺组及恩扎卢胺+ [¹⁷⁷Lu]Lu-PSMA-617 组总生存期
3.前列腺癌患者血浆雄激素受体变化与强化激素治疗的时机选择:STAMPEDE 3 期随机临床试验
发表期刊:JAMA Oncol
背景:我们之前报道,在雄激素剥夺治疗(ADT)开始时加入醋酸阿比特龙(以下简称阿比特龙)和强的松龙可改善转移性及极高危局部晚期前列腺癌患者的生存,而联合恩扎卢胺并未改变疗效。通过对血浆DNA进行二代测序,我们发现当仅接受 ADT 治疗进展后启动阿比特龙或恩扎卢胺治疗时,雄激素受体(AR)基因的基因组突变与耐药相关。目前尚不清楚在 ADT 开始时进行激素强化治疗是否会改变 AR 基因和/或增强子区域。
方法:STAMPEDE 平台试验(NCT00268476)的详细方案已发表。血液样本采集自试验定义的进展期患者(自愿捐赠)。患者随访至 2022 年 7 月,并纳入英格兰和威尔士国家登记处截至 2024 年 2 月记录的死亡数据。生物标志物分析获独立研究伦理委员会批准(REC18/LO/1235)。采用 PCF-SELECT 检测法分析血浆 DNA 。基于早期芳香化酶抑制剂减少乳腺癌 ESR1 突变的研究,在样本采集前预设的零假设为:早期激素强化治疗不影响 AR 基因突变的发生率。本研究遵循 CONSORT 报告指南。
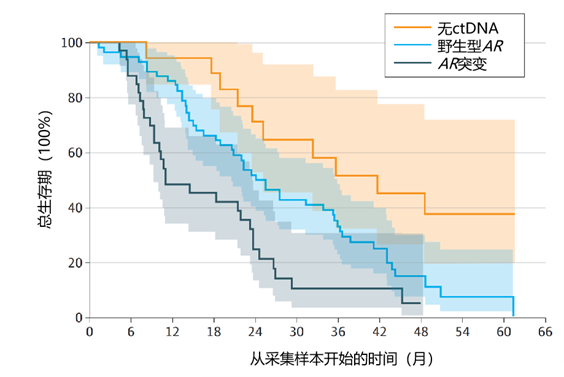
结果:2016 年3 月至 2020 年 1 月,从 110 例患者( 2014 年 8 月至 2016 年 3 月随机分配接受 ADT 治疗 58 例[对照组]或 ADT 联合恩扎卢胺+阿比特龙治疗 52 例)的进展期血浆样本中,108 例通过质量控制。对照组 57 例中 44 例(77%)、强化组 51 例中 46 例(90%)检测到循环肿瘤 DNA(ctDNA)。对照组 44 例中 11例(25%;95% CI 13%-40%)存在至少1个 AR 突变,强化组 46 例中 22 例(48%;95% CI 33%-63%) AR 突变比例显著更高(χ² 检验p=0.03),拒绝零假设。强化组 AR 突变高于对照组(优势比0.36;95% CI 0.15-0.89)。对照组和强化组从随机分组到样本采集的中位(IQR)时间分别为 20(14-24)个月和 20(14-27)个月,但 AR 突变样本的采集时间更短(Wilcoxon检验p=0.03)。AR 基因拷贝数与增强子拷贝数高度相关(Pearson 相关系数r=0.94;p<2.2×10-16),提示无论治疗方式如何,AR 扩增常涉及两个区域。尽管样本量限制了分析敏感性,但未发现非 AR 基因突变的发生率在治疗组间存在显著差异。与野生型 AR 或无 ctDNA 者相比,AR 突变患者一线进展后死亡风险更高(见图3)。
讨论:本研究证实阿比特龙和/或恩扎卢胺治疗后 AR 相关基因组突变的选择压力显著,且与 3b 期 PRESIDE 试验中恩扎卢胺治疗转移性去势抵抗性前列腺癌进展时的检测结果一致(同一分析流程)。这支持无论治疗启动时机如何, AR 通路抑制剂进展后均可采用相同治疗策略。
图3.野生型 AR 或无 ctDNA 者相比,AR 突变患者一线进展后总生存期
4.局部晚期和转移性激素敏感性前列腺癌的联合治疗
发表期刊:EurUrol
背景与目标:过去十年间,晚期前列腺癌的治疗格局发生了显著变化。多西他赛、雄激素受体通路抑制剂(ARPIs)、聚腺苷二磷酸核糖聚合酶抑制剂及靶向放射性核素的引入,重新定义了治疗范式,目前的重点在于通过联合疗法实现早期强化治疗。本叙述性协作综述总结了局部晚期及转移性激素敏感性前列腺癌(mHSPC)中联合疗法的现有证据。
方法:我们进行了截至 2024 年 11 月的文献检索,检索词包括“转移性激素敏感性前列腺癌”“转移性去势敏感性前列腺癌”“局部晚期前列腺癌”“联合治疗”“强化治疗”及“降阶梯治疗”。作者基于科学价值、临床影响及相关性筛选文献,旨在总结局部晚期前列腺癌及 mHSPC 中联合疗法的证据。
主要发现与局限性:以雄激素剥夺治疗(ADT)为基础联合 ARPI 的双药方案已成为 mHSPC 的标准治疗,而特定亚组可考虑加入多西他赛的三药方案。为改善高危局限性及局部晚期患者生存,多项试验评估了在标准治疗(手术或放疗联合 ADT)基础上联合其他疗法的获益。生存持续改善促使研究转向优化强化治疗的患者选择,甚至在某些情况下探索降阶梯治疗,以减少不必要的过度治疗并降低长期毒性风险。随着前列腺特异性膜抗原正电子发射断层扫描的应用,转移性疾病更早被发现,这一点尤为重要。
结论与临床意义:在特定亚组中,早期联合强化治疗可改善生存,但可能伴随长期毒性。
5.恩扎卢胺对生化复发前列腺癌患者性活动的影响: EMBARK 研究患者报告结局的事后分析
发表期刊:Eur Urol
背景:EMBARK试验显示,对于高危前列腺癌生化复发患者,恩扎卢胺±亮丙瑞林对比单独亮丙瑞林可延长无转移生存期,同时维持健康相关生活质量(HRQoL)。
方法:为评估治疗对性活动(SA)的影响,本研究对 SA 相关 HRQoL 进行条目级分析。 HRQoL 评估(基线、每12周)持续至发生转移或死亡。采用 Cox 回归分析确认具有临床意义的恶化时间(TTCD;需下次访视确认),并通过混合模型重复测量分析 HRQoL 纵向变化。
结果:与单独亮丙瑞林相比,恩扎卢胺单药治疗显著延缓了以下指标的 TTCD:
性欲( 8.5 个月vs 5.6 个月;风险比[HR]0.70,95%CI 0.57–0.87;p<0.001)。性活动程度( 5.7 个月vs 3.0 个月;HR 0.69,95% CI 0.54–0.90;p=0.004)。性生活满意度( 11.1个 月vs 5.4 个月;HR 0.61,95% CI 0.45–0.84;p=0.001)。勃起功能( 5.5 个月vs 2.9 个月;HR 0.67,95% CI 0.50–0.88;p=0.003)。恩扎卢胺+亮丙瑞林与单独亮丙瑞林在 SA 相关 HRQoL 的 TTCD 方面相似,但勃起功能 TTCD 中位数缩短 0.1 个月(3天),差异有统计学意义(p<0.05),但无临床意义。纵向分析显示,各组从基线至 205 周的 SA 相关条目均未出现具有临床意义的变化。
结论:恩扎卢胺单药治疗在维持 SA 相关 HRQoL 方面优于单独亮丙瑞林。
6.预测前列腺癌放疗剂量反应:III期随机临床试验 NRG/RTOG 0126 和 SAKK 09/10 中辐射特征的验证
发表期刊:Ann Oncol
背景:SAKK09/10 试验将生化复发前列腺癌患者随机分配接受挽救性放疗 64Gy 或 70Gy ,而 NRG/RTOG0126 试验将中危前列腺癌患者随机分配接受根治性放疗 70.2Gy 或 79.2Gy 。我们研究了先前开发的术后放疗结果评分(PORTOS),以确定从放疗剂量递增(DE)中优先获益的人群。
材料与方法:在 SAKK09/10和NRG/RTOG0126 试验中,对通过质量控制的可用组织样本患者(n=226、215)进行 PORTOS 评估。SAKK09/10试验采用已发表的术后组数据,而 NRG/RTOG0126 试验因活检样本和根治性放疗患者未建立临界值,故采用三分位数分析。此外,还分析了 42407 例前列腺切除术和 31107 例活检样本的真实世界数据集的临床及分子相关性。
结果:在 SAKK09/10 试验中,PORTOS(低分组vs高分组)与治疗组之间在临床无进展生存期上存在显著的生物标志物-治疗相关性,仅高PORTOS组患者从DE中获益。在 NRG/RTOG0126 试验中,低 PORTOS 三分位数患者的 Phoenix 生化失败(BF)无差异;但平均及高 PORTOS 三分位数患者从 DE 中显著获益。交互作用检验显示,高、低 PORTOS 组间 DE 获益存在显著差异。在两项试验及真实世界数据集中,PORTOS 与临床病理变量无强相关性,但在真实世界数据集中,PORTOS 与缺氧特征弱相关,与免疫特征及亚型强相关。
结论:在 SAKK09/10 和RTOG0126 随机对照试验中,PORTOS 可潜在识别从 DE 中获益的患者亚群,而该亚群无法通过临床病理或预后变量区分。这些结果提示 PORTOS 可能成为临床放疗反应的预测指标。
图4.SAKK 09/10 研究中低 PORTOS 和高 PORTOS 患者接受不同强度放疗的临床无进展生存期

7.雄激素受体抑制上调 MHC I 类表达并增强前列腺癌免疫应答
发表期刊:Cancer Discov
背景:抗肿瘤免疫的一个基本组成部分是肿瘤细胞表面主要组织相容性复合体I类(MHC I)的表达。过去十年中,通过 MHC I 缺失实现免疫逃逸的机制已被阐明。此外,免疫检查点阻断(ICB)耐药性与 MHC I 缺失相关。鉴于此,人们已投入大量努力研究免疫治疗耐药机制。某些机制似乎在肿瘤类型间共享(如 PD-1+淋巴细胞),而另一些则具有组织特异性。正如病毒根据组织嗜性采用不同免疫逃逸策略,肿瘤细胞可能也存在反映其组织微环境独特属性和/或癌基因成瘾性的免疫逃逸机制。在此背景下,前列腺癌是研究雄激素与肿瘤免疫逃逸相互作用的理想疾病模型。
方法:在本研究里,我们运用全基因组 CRISPR干扰(CRISPRi)流式细胞术筛选法,来找出前列腺癌细胞中 MHC I 的调控因子。借助体外和体内模型,验证了雄激素受体(AR)信号通路中的重要靶点是 MHC I 的抑制因子,并且在四项二期临床试验中也观察到了这一现象。
结果:肿瘤通过多种机制逃避免疫系统的检测与清除。本研究以前列腺癌为模型,探讨雄激素依赖性肿瘤如何通过下调主要组织相容性复合体I类(MHC I)分子实现免疫逃逸。我们发现,晚期前列腺癌对免疫治疗的应答与 MHC 表达升高相关。为揭示其机制,我们开展了全基因组 CRISPR 干扰(CRISPRi)筛选,发现雄激素受体(AR)是 MHC I 通路的抑制因子。Ar 基因缺陷的侵袭性前列腺癌同基因小鼠模型显示肿瘤免疫原性增强,并促进 T 细胞介导的肿瘤控制。值得注意的是,AR 阻断后 MHC I 表达的增加是短暂的,且与 AR 抑制剂耐药相关。机制研究发现,在 MHC I 转录起始位点上游存在雄激素反应元件,其缺失可增强 MHC I 表达。本研究揭示了激素促进免疫逃逸的新机制。
结论:前列腺癌等“免疫冷肿瘤”的免疫治疗选择有限。我们证实 AR 通过下调 MHC I 表达/抗原呈递抑制免疫应答,而 AR 抑制可增强 T 细胞反应和肿瘤控制。这提示联合 AR 抑制剂与免疫检查点阻断的治疗策略可能改善患者的肿瘤免疫监视和抗肿瘤免疫。
肾癌
8.一种新抗原疫苗在肾细胞癌中诱导抗肿瘤免疫
发表期刊:Nature
个性化癌症疫苗(PCVs)可针对预测的新抗原引发循环免疫应答。然而,此类应答能否靶向癌症驱动突变、诱导肿瘤免疫识别并产生临床疗效仍存争议,尤其在低突变负荷肿瘤患者中。本研究开展了一项Ⅰ期临床试验(ClinicalTrials.gov 注册号 NCT02950766),评估新抗原靶向 PCV 在高危、完全切除的透明细胞肾细胞癌(RCC;Ⅲ 或 Ⅳ 期)患者中的安全性及免疫原性,部分患者在疫苗接种同期联用伊匹木单抗。术后中位随访 40.2 个月时,入组的 9 例患者均未出现 RCC 复发,且未观察到剂量限制性毒性。所有患者均产生了针对 PCV 抗原的 T 细胞免疫应答,包括对 VHL、PBRM1、BAP1、KDM5C 和 PIK3CA 等 RCC 驱动突变的应答。接种后,外周血 T 细胞克隆呈现持续扩增,9 例患者中有7例检测到针对自体肿瘤的 T 细胞反应性。研究结果表明,高危 RCC 患者中应用新抗原靶向 PCV 具有高度免疫原性,可有效靶向关键驱动突变并诱导抗肿瘤免疫。结合所有接种患者均未复发的观察结果,本研究彰显了 PCV 作为 RCC 有效辅助治疗的潜力。
9.三级淋巴结构及耗竭性组织驻留T细胞决定肾细胞癌对PD-1抑制剂的临床反应
发表期刊:Cancer Discov
背景:靶向 PD-1 通路的免疫检查点抑制剂(ICI)已彻底改变晚期肾细胞癌(RCC)的治疗格局,但治疗应答的潜在机制仍不明晰。
方法:本研究对一项一线纳武利尤单抗 Ⅱ 期临床试验(NCT03117309)中 102 例 RCC 患者的生物样本进行转录组学分析,旨在探索抗 PD-1 单药治疗应答的决定因素。
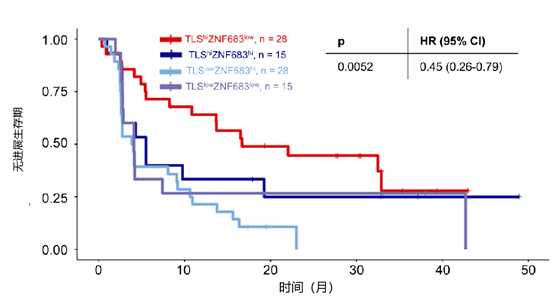
结果:通过整体分析,我们发现应答患者中与三级淋巴结构(TLS)相关的基因显著富集。利用单细胞转录组学及外部队列验证,我们鉴定出一群组织驻留(ZNF683+SLAMF7+)耗竭 CD8+T 细胞,其在临床结局不良患者中富集。综合分析表明,高 TLS 且低组织驻留耗竭 CD8+T 细胞的肿瘤接受纳武利尤单抗治疗具有更佳临床结局(见图5)。本研究增进了对肿瘤微环境如何驱动 ICI 耐药的理解,并提出了可能的治疗靶点以克服抗 PD-1 单药耐药。
结论:我们首次提出,RCC 中高 TLS 与低组织驻留耗竭 CD8+T 细胞的联合特征是 PD-1 阻断治疗获得最佳应答的必要条件。本研究明确了晚期 RCC 对 PD-1 阻断治疗应答的关键决定因素,并通过合理联合治疗策略为未来免疫调控提供了方向。
图5.高低 TLS 与高低组织驻留耗竭 CD8+T 细胞的肿瘤接受纳武利尤单抗治疗的无进展生存期
10.肾细胞癌免疫检查点抑制剂“超常反应”的免疫基因组决定因素
发表期刊:Nat Cancer
背景:免疫检查点抑制剂可在部分人群中诱导“异常”持久应答,但转移性透明细胞肾细胞癌(mccRCC)中免疫治疗异常应答(ER)的分子基础尚未明确。
方法:本研究分析了接受标准免疫治疗的初治 mccRCC 患者的治疗前基因组和转录组数据:(1)程序性细胞死亡蛋白/配体1(PD1/PDL1)与细胞毒性 T 淋巴细胞相关蛋白 4 抑制剂联合(IO/IO);(2)PD1/PDL1 与血管内皮生长因子(VEGF)受体抑制剂联合(IO/VEGF)。
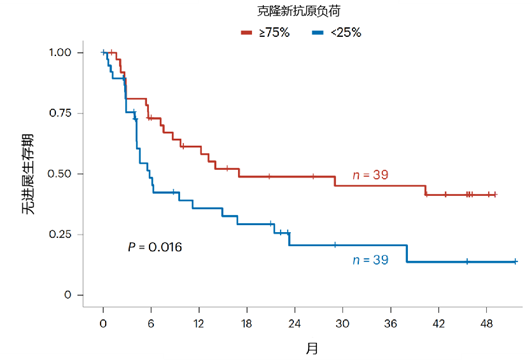
结果:在 IO/IO 队列中,ER 患者的克隆新抗原负荷显著更高;在 IO/VEGF 队列中,ER 患者表现出 B 细胞受体信号通路的强烈富集、三级淋巴结构(TLS)特征及代谢活性增强的证据。研究结果表明,ER 可能与克隆新抗原驱动的细胞毒性 T 细胞应答及肿瘤微环境中 TLS 形成相关。同时激发 T 细胞和 B 细胞导向抗肿瘤免疫的联合治疗策略,对透明细胞肾细胞癌(ccRCC)患者从基于 IO 治疗获得异常获益至关重要。
结论:本研究首次揭示 mccRCC 中 ER 与克隆新抗原负荷及 TLS 形成的关联,为通过联合靶向 T/B 细胞免疫通路优化免疫治疗方案提供了理论依据。
图6.高低克隆新抗原负荷患者接受 IO/IO 治疗的无进展生存期
参考文献
- Marvaso G, Corrao G, Zaffaroni M, et al. ADT with SBRT versus SBRT alone for hormone-sensitive oligorecurrent prostate cancer (RADIOSA): a randomised, open-label, phase 2 clinical trial [J]. Lancet Oncol. 2025;26(3):300-311.
- Emmett L, Subramaniam S, Crumbaker M, et al. Overall survival and quality of life with [177Lu]Lu-PSMA-617 plus enzalutamide versus enzalutamide alone in metastatic castration-resistant prostate cancer (ENZA-p): secondary outcomes from a multicentre, open-label, randomised, phase 2 trial [J]. Lancet Oncol. 2025 Mar;26(3):291-299.
- Leone G, Orlando F, Dutey-Magni P, et al. Plasma AR alterations and timing of intensified hormone treatment for prostate cancer: the STAMPEDE phase 3 randomized clinical trial [J]. JAMA Oncol.2025 Feb 27:e247051.
- Azad AA, Kostos L, Agarwal N, et al. Combination therapies in locally advanced and metastatic hormone-sensitive prostate cancer [J]. Eur Urol. 2025 Feb 12:S0302-2838(25)00023-5.
- Freedland SJ, Mulhall JP, Gleave M, et al. Effects of enzalutamide on the sexual activity of patients with biochemically recurrent prostate cancer: a post hoc analysis of patient-reported outcomes in the EMBARK study [J]. Eur Urol. 2025 Feb 26:S0302-2838(25)00094-6.
- Dal Pra A, Ghadjar P, Ryu HM, et al. Predicting dose response to prostate cancer radiotherapy: validation of a radiation signature in the randomized phase III NRG/RTOG 0126 and SAKK 09/10 trials [J]. Ann Oncol. 2025 Feb 13:S0923-7534(25)00025-0.
- Chesner LN, Polesso F, Graff JN, et al. Androgen receptor inhibition increases MHC class I expression and improves immune response in prostate cancer [J]. Cancer Discov. 2025 Mar 3;15(3):481-494.
- Braun DA, Moranzoni G, Chea V, et al. A neoantigen vaccine generates antitumour immunity in renal cell carcinoma [J]. Nature. 2025 Feb 5.
- Hugaboom MB, Wirth LV, Street K, et al. Presence of tertiary lymphoid structures and exhausted tissue-resident T cells determines clinical response to PD-1 blockade in renal cell carcinoma [J]. Cancer Discov. 2025 Feb 24.
- Jammihal T, Saliby RM, Labaki C, et al. Immunogenomic determinants of exceptional response to immune checkpoint inhibition in renal cell carcinoma [J]. Nat Cancer. 2025 Feb;6(2):372-384.



