- 用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒感染(COVID-19)患者。
- 如伴有以下至少一种疾病或条件,则认为具有进展为重症COVID-19的高风险因素:

- 本品的批准使用不仅限于上述医学状况或者因素,其他医学状况或者因素(如:人种或种族)也可能使个体患者处于进展为重症COVID-19的高风险,应权衡个体患者的获益与风险
(1)方法1
- 口服。本品可与食物同服,也可不与食物同服。片剂需整片吞服,不得咀嚼、掰开或压碎。
- 本品为奈玛特韦片与利托那韦片的组合包装,必须同服;如奈玛特韦不与利托那韦同服,奈玛特韦的血浆药物浓度可能不足以达到所需的治疗效果。

(2)剂量1
- 推荐剂量为奈玛特韦300mg(150mg×2 片)联用利托那韦100mg(100mg×1 片),每12 小时1 次口服给药,连续服用5 天。
- 在COVID-19确诊及出现症状后5 天内尽快服用本品。如果患者在开始本品治疗后因重症或危重COVID-19需要住院,也建议完成5 天的治疗。

(3)漏服1
- 如果患者漏服一剂本品但未超过通常服药时间的8 小时,则应尽快补服并按照正常的给药方案继续用药。
- 如果患者漏服且通常给药时间的超过 8小时,则不应补服漏服的剂量,而应按照规定的时间服用下一剂量。请勿为弥补漏服的剂量而服用双倍剂量。
(4)过量1
- 本品药物过量的治疗应包括一般支持性措施(包括监测生命体征和观察患者的临床状态等)。本品用药过量没有特效解毒剂。
- 轻度肾功能不全患者(eGFR≥60至<90mL/min)无需调整剂量。
- 中度肾功能不全患者(eGFR≥30至<60mL/min)应将本品的剂量减少至奈玛特韦/利托那韦150mg/100mg,每12 小时一次,持续5天,以避免过度暴露。
- 重度肾功能不全患者(eGFR<30mL/min)不应使用本品,包括血液透析下的终末期肾病(ESRD)(参见后文肾功能不全患者药代动力学 )。
- 目前没有关于严重肾功能损伤患者(包括ESRD患者)的临床数据,在严重肾功能不全患者中使用本品可能会导致过度暴露并产生潜在毒性。在进行专门研究之前,现阶段无法详细说明剂量调整方面的建议。

- 轻度(Child-Pugh A 级)或中度(Child-Pugh B 级)肝功能不全患者无需调整本品剂量。
- 目前尚无严重肝功能不全患者的药代动力学和临床数据。因此,本品不应用于严重肝功能不全的患者。
- 接受利托那韦治疗的患者曾发生肝转氨酶升高、有临床表现的肝炎和黄疸。因此,既往有肝脏疾病、肝酶异常或者肝炎病史的患者应慎用本品。
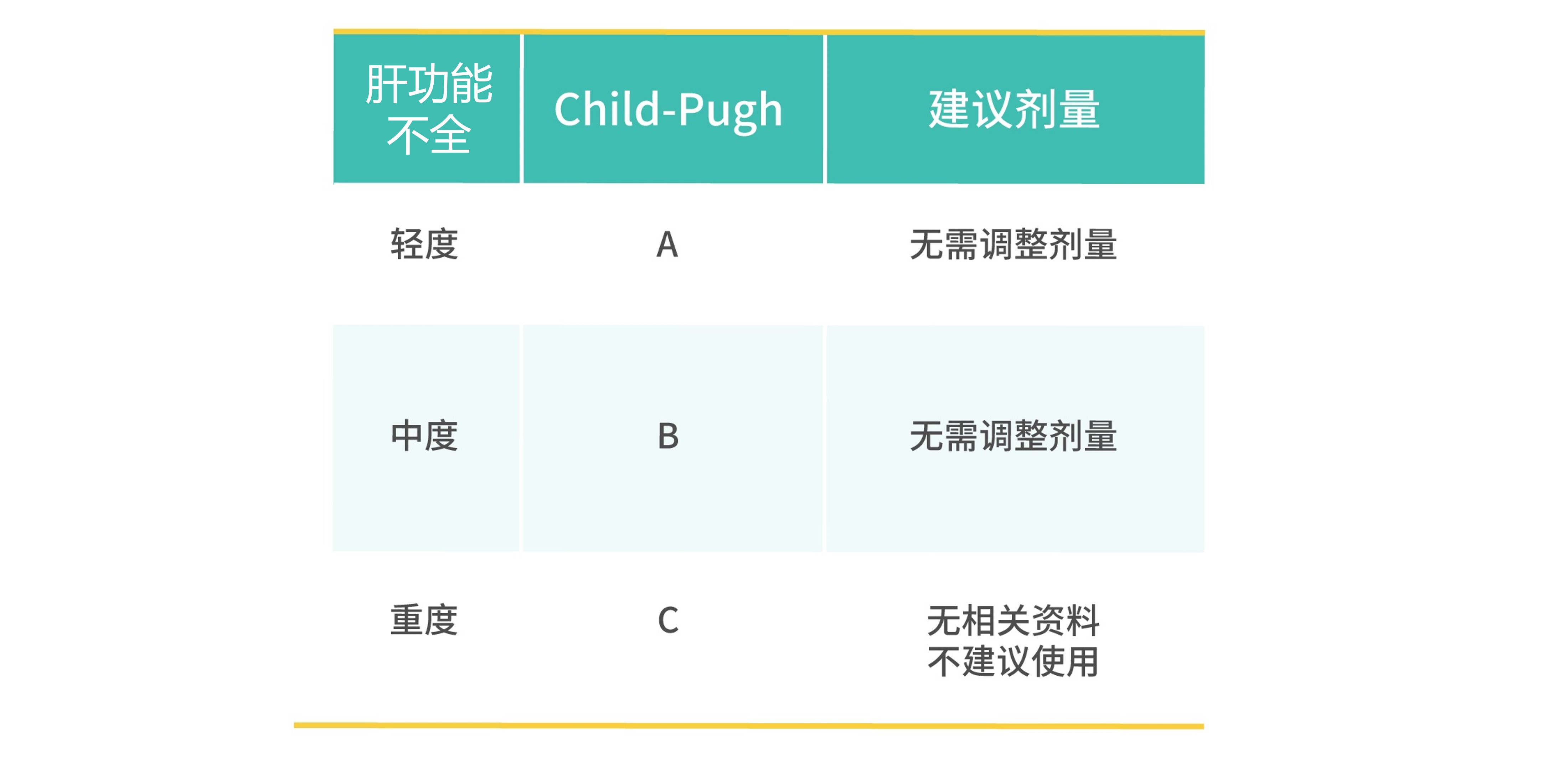
Child-Pugh 肝功能改良分级法2

(1)有生育潜能的女性:
- 尚无妊娠期间使用本品的数据,因而不了解药物相关不良发育结局的风险;育龄女性在本品治疗期间以及本品治疗结束后7天应避免怀孕。
- 利托那韦与激素类避孕药联用时可能降低后者的疗效。应建议使用复方激素类避孕药的患者在本品治疗期间以及停用本品后的一个月经周期内使用有效的替代避孕方法或额外的屏障避孕方法。
(2)妊娠:
- 妊娠女性使用本品的数据有限。只有母亲的潜在获益大于对胎儿的潜在风险时,才能在妊娠期间使用本品。
- 动物研究数据表明,奈玛特韦在兔中可见发育毒性(胎仔体重降低),但在大鼠中未见此类证据。
- 大量妇女在妊娠期间暴露于利托那韦,这表明与基于人群的出生缺陷监测系统中观察到的发生率相比,出生缺陷发生率没有增加。动物实验数据显示利托那韦具有生殖毒性。
已有在妊娠期妇女中用药的真实世界数据相关文献发表,我们对其进行总结并撰写了医学综述。如果您想了解详细内容,可以点击链接查看该文档。
(3)哺乳期:
- 目前尚无哺乳期使用本品的数据,无法排除对新生儿/婴儿的风险。
- 尚不清楚奈玛特韦是否会分泌至人或动物乳汁中,及其对母乳喂养的新生儿/婴儿的影响或对乳汁分泌的影响。已发表的数据中,关于人乳中存在利托那韦的报告有限。尚无关于利托那韦对母乳喂养新生儿/婴儿的影响或药物对泌乳量影响的信息。
- 故本品治疗期间以及本品治疗结束后7天应停止哺乳。
(4)生育力:
- 尚无关于本品或单独使用利托那韦对生育力影响的人体数据。奈玛特韦和利托那韦单独进行动物试验,对大鼠生育力均未见影响。
下表按照系统器官分类和出现频率列出了不良反应。频率定义如下:十分常见(≥1/10)、常见(≥1/100 到< 1/10)、偶见(≥1/1,000 到< 1/100)、罕见(≥1/10,000 到<1/1,000)以及未知(无法从目前的数据中估计)。
| 系统器官分类 | 常见 | 偶见 | 罕见 |
|---|---|---|---|
| 免疫系统疾病 | 超敏反应,包括瘙痒和皮疹 | 速发严重过敏反应 | |
| 胃肠系统疾病 | 腹泻、呕吐、恶心 | 消化不良、胃食管反流病、腹痛 | 阿弗他溃疡、结肠炎、口干、稀便 |
| 全身性疾病及给药部位各种反应 | 胸部不适、难受 | ||
| 代谢及营养类疾病 | 食欲减退 | ||
| 各种肌肉骨骼及结缔组织疾病 | 肌痛 | ||
| 各类神经系统疾病 | 味觉倒错 | 头晕 | 头痛、嗅觉异常 |
| 血管与淋巴管类疾病 | 高血压 | ||
| 精神病类 | 焦虑 | ||
| 呼吸系统、胸及纵隔疾病 | 呼吸困难、呃逆、口咽疼痛 | ||
| 皮肤及皮下组织类疾病 | 斑丘疹、皮肤剥脱 | ||
| 各类检查 | 丙氨酸氨基转移酶(ALT)升高、天门冬氨酸氨基转移酶(AST)升高 | 血促甲状腺激素(TSH)降低 |
了解奈玛特韦片/利托那韦片的药物相互作用
长按识别或扫描下方小程序二维码
或参考奈玛特韦片/利托那韦片组合包装说明书

其他查询工具
可访问Liverpool COVID-19 药物相互作用查询网站获取奈玛特韦/利托那韦与其他某药物之间的相互作用的信息
请注意,以上数据库信息不代表辉瑞公司立场。我们不能保证如上资源覆盖全部相关内容。
相关指南/指导
美国感染病学会(IDSA)COVID-19治疗指南-奈玛特韦/利托那韦药物相互作用:
法国药理学和治疗学会(SFPT)指南
基于以色列临床实践的奈玛特韦/利托那韦治疗患者 DDI管理建议
Managing Potential Drug Interactions of Nirmatrelvir/Ritonavir in COVID-19 Patients: A Perspective from an Israeli Cross-Sector Collaboration - PubMed (nih.gov)
2023 王钊等 《临床药物治疗杂志》
奈玛特韦片/利托那韦片药物相互作用与用药指导
2023 《奈玛特韦片/利托那韦片与心血管药物相互作用实用药学建议》编写组 《临床药物治疗杂志》
奈玛特韦片/利托那韦片与心血管药物相互作用实用药学建议
请注意,以上指南/指导中的推荐意见不代表辉瑞公司立场。辉瑞对第三方网站内容或服务不承担任何责任或义务。我们建议您查看您可能选择访问网站的相关政策和条款。
如需文献原文,请您联系辉瑞医学信息部。
可访问Liverpool COVID-19 药物相互作用查询网站获取奈玛特韦/利托那韦与其他某药物之间的相互作用的信息
请注意,以上数据库信息不代表辉瑞公司立场。我们不能保证如上资源覆盖全部相关内容。
美国国立卫生研究院 (NIH) COVID-19 治疗指南-奈玛特韦/利托那韦药物相互作用:Paxlovid Drug-Drug Interactions | COVID-19 Treatment Guidelines (nih.gov) [查看原文]
美国感染病学会(IDSA)COVID-19治疗指南-奈玛特韦/利托那韦药物相互作用:Management of Drug Interactions With Nirmatrelvir/Ritonavir (Paxlovid®): Resource for Clinicians (idsociety.org) [查看原文]
法国药理学和治疗学会(SFPT)指南:Management of drug-drug interactions with nirmatrelvir/ritonavir in patients treated for Covid-19: Guidelines from the French Society of Pharmacology and Therapeutics (SFPT) - PubMed (nih.gov)[查看原文]
基于以色列临床实践的奈玛特韦/利托那韦治疗患者 DDI管理建议:Managing Potential Drug Interactions of Nirmatrelvir/Ritonavir in COVID-19 Patients: A Perspective from an Israeli Cross-Sector Collaboration - PubMed (nih.gov)[查看原文]
2023 王钊等,奈玛特韦片/利托那韦片药物相互作用与用药指导[J]. 临床药物治疗杂志, 2023, 21(1): 21-26. [点击下载]
2023 《奈玛特韦片/利托那韦片与心血管药物相互作用实用药学建议》编写组 《临床药物治疗杂志》,奈玛特韦片/利托那韦片与心血管药物相互作用实用药学建议 [点击下载]
请注意,以上指南/指导中的推荐意见不代表辉瑞公司立场。辉瑞对第三方网站内容或服务不承担任何责任或义务。我们建议您查看您可能选择访问网站的相关政策和条款。
如需指南共识原文,请您联系辉瑞医学信息部:[email protected], 或通过辉瑞医学信息网站在线提问获取。
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
奈玛特韦是SARS-CoV-2中3C-样蛋白酶(3CLpro)的抑制剂,其可使3CLpro无法处理多蛋白前体,从而阻止病毒复制;利托那韦可抑制CYP3A介导的奈玛特韦代谢,从而升高奈玛特韦的血药浓度1。
为什么选择3CLpro作为药物靶点?
- 3CLpro 是SARS-CoV-2的一种功能蛋白,在病毒复制周期中具有重要作用 3,4:SARS-CoV-2进入宿主细胞后,RNA(+)基因组迅速翻译出两种多聚蛋白 ,随后这两种多聚蛋白被病毒编码的两种蛋白酶裂解成16种功能蛋白;而这两种蛋白酶之一即为3CLpro(也称主要蛋白酶Mpro)。
- 所有冠状病毒的3CLpro结构与功能都是高度保守的,SARS-CoV-1和SARS-CoV-2的3CLpro序列同源性约为96%。所以,靶向3CLpro的药物具有广谱抗冠状病毒潜力,并且降低潜在新病毒株耐药相关突变的可能性5,6。
- 3CLpro独特的识别序列与任何已知的人类蛋白酶无相关性,其靶向药物具有高选择性和低副作用的潜力3,5,7,8,9,10。
抗SARS-CoV-2重要的药物靶点:3CLpro和RdRp

体外抗病毒活性
奈玛特韦对 dNHBE 细胞(一种原代人肺泡上皮细胞系)的 SARS-CoV-2 (USA-WA1/2020 分离株)感染表现出抗病毒活性,药物暴露3天后,EC50 和 EC90 值分别为 62 nM和181nM1。
在P-gp抑制剂存在下,在Vero E6-TMPRSS2细胞中评估了奈玛特韦相对于Omicron亚分支BA.2、BA.2.12.1、BA.4、BA.4.6、BA.5、BF.7 (P252L+F294L)、BF.7 (T243I)、BQ.1.11、BQ.1、XBB.1.5、EG.5和JN.1的抗病毒活性。奈玛特韦相对于Omicron亚分支的EC50值范围:39-146nM,相对于 USA-WA1/2020,EC50值倍数变化≤1.8。
此外,在Vero E6 P-gp基因敲除细胞中评估了奈玛特韦对SARS-CoV-2 α,β,γ,δ,λ,Mu和Omicron BA.1变异株感染的抗病毒活性。奈玛特韦的中位EC50值为25 nM(范围:16-141nM)。β是测试中最不敏感的变异株,相对于USA-WA1/2020,EC50值倍数变化为3.7。其他变异株的EC50值倍数变化相对于USA-WA1/2020≤1.11。
体外研究评估了奈玛特韦对SARS-CoV-2不同谱系的活性。几位作者得出结论,奈玛特韦对原始毒株以及其他需关注的变异株(包括Alpha,Beta,Delta,Gamma,Lambda和Zeta变体)保持有效抑制14-18。
数项实验室研究在多细胞系中已证明奈玛特韦对奥密克戎变异株具有有效的抗病毒活性,包括BA.1、BA.2、BA.4、BA.5、BQ.1.1、XBB、BA.2.75、BA.4.6、XBB1.5和JN.1。15-31
细胞培养和生化试验中的抗病毒耐药性1
已通过多种不同的方法确定了可能与奈玛特韦耐药性相关的SARS-CoV-2 Mpro残基,这些方法包括 SARS-CoV-2 耐药性选育、携带Mpro置换突变的重组SARS-CoV-2病毒的试验,以及采用发生氨基酸置换突变的重组 SARS-CoV-2 Mpro 进行的生化试验。下表列出了在细胞培养中经奈玛特韦选择的SARS-CoV-2 Mpro置换以及Mpro置换组合。所列的单个Mpro 置换可能单独存在,也可能伴随其他 Mpro 置换。请注意,Mpro S301P 和 T304I 置换覆盖了 Mpro C末端 nsp5/nsp6 切割位点的 P6 和 P3 位。细胞培养中其他 Mpro 切割位点的置换与奈玛特韦耐药性的产生不相关。这些置换的临床意义尚不清楚。
细胞培养中经奈玛特韦选择的 SARS-CoV-2 Mpro 氨基酸置换(EC50 变化大于 5 倍) |
|---|
| S144A (2.2-5.3)、E166V (25-288)、P252L (5.9)、T304I (1.4-5.5)、T21I+S144A (9.4)、T21I+E166V (83)、T21I+T304I (3.0-7.9)、L50F+E166V (34-175)、L50F+T304I (5.9)、F140L+A173V (10.1)、A173V+T304I (20.2)、T21+L50F+A193P+S301P (28.8)、T21I+S144A+T304I (27.8)、T21I+C160F+A173V+V186A+T304I (28.5)、T21I+A173V+T304I (15)、L50F+F140L+L167F+T304I (54.7) |
与野生型SARS CoV 2相比,大多数单独和某些双重Mpro氨基酸置换使SARS CoV 2对奈玛特韦的敏感性下降,导致EC50升高(变化小于5倍)。三重和某些双重Mpro氨基酸置换通常使 EC50升高至大于野生型的5倍。这些置换的临床意义有待进一步探索。
病毒载量反跳
在EPIC-HR研究的本品和安慰剂亚组中,不论受试者有何种COVID-19症状,在第10天和/或第14天均观察到治疗后鼻腔病毒RNA反跳。EPIC-HR研究的本品组和安慰剂组均有受试者发生病毒反跳,但数据上本品组的发生率更高(6.3% vs 4.2%)。COVID-19病毒反跳和症状复发未见进展为重症,包括住院、死亡或耐药性出现。
已在中国健康受试者中开展了奈玛特韦/利托那韦的药代动力学研究。
中国健康受试者空腹单次、多次口服奈玛特韦片/利托那韦片300mg/100mg后,奈玛特韦Tmax的中位值在第1天、第10天分别为1.76h、2.00h,Cmax的几何均值在第1天、第10天分别为3082ng/mL、4500ng/mL,AUC12(第1天)、AUCtau(第10天)几何均值分别为19660ng•hr/mL、32010ng•hr/mL。多次给药后奈玛特韦的半衰期T1/2约为 6.8h。Cmax、AUCtau的蓄积比分别为1.461、1.627。
利托那韦为CYP3A4抑制剂,与奈玛特韦联用后可增加奈玛特韦全身暴露,且奈玛特韦的半衰期稍有延长。
境外研究数据显示,健康受试者单次空腹口服奈玛特韦混悬剂250mg后AUCinf、AUClast、Cmax的几何均值分别为3513ng•h/mL、3318ng•h/mL、883.1ng/mL,半衰期T1/2约为5.6h;单次口服奈玛特韦混悬剂/利托那韦片250mg/100mg后奈玛特韦AUCinf、AUClast、Cmax的几何均值分别为28220ng•h/mL、27600ng•h/mL、2882ng/mL,半衰期T1/2约为6.9h。
| 参数 | 奈玛特韦混悬剂/RTV片 250mg/100mg (N=4) | 奈玛特韦混悬剂250mg (N=4) |
|---|---|---|
| AUCinf (h⋅ng/mL) | 28220(14%) | 3513(38%) |
| AUClast(h⋅ng/mL) | 27600(13%) | 3318(35%) |
| Cmax(ng/mL) | 2882(25%) | 883.1(37%) |
| T1/2(h) | 6.935±1.0794 | 5.626±3.0407 |
| Tmax(h) | 2.75(1.50~4.00) | 1.00(0.500~4.00) |
表中数据为几何平均值(几何%CV),其中Tmax为中位数(范围),t1/2为算术平均值±SD。后面表格相同。
健康受试者单次空腹口服奈玛特韦混悬剂/利托那韦片250mg/100mg~750mg/100mg,奈玛特韦暴露量增加比例小于剂量增加比例。多次口服奈玛特韦混悬剂/利托那韦片75mg/100mg~500mg/100mg后,奈玛特韦暴露量增加比例小于剂量增加比例,奈玛特韦在第2天达到稳态。第5天与第10天的暴露相当,蓄积约为第1天的2倍。
吸收
健康受试者单次空腹口服奈玛特韦片/利托那韦片300mg/100mg后,血浆奈玛特韦Cmax、AUClast、AUCinf的几何均值分别为2210ng/mL、22450h·ng/mL、23010h·ng/mL,T1/2为6h,中位Tmax为3h。血浆利托那韦Cmax、AUClast、AUCinf的几何均值分别为359.3ng/mL、3414h·ng/mL、3599h·ng/mL,T1/2为6h,中位Tmax为4h。
| 参数 | 奈玛特韦片/利托那韦片300mg/100mg(N=12) | |
|---|---|---|
| 奈玛特韦 | 利托那韦 | |
| AUCinf(h⋅ng/mL) | 23010(23%) | 3599(47%) |
| AUClast(h⋅ng/mL) | 22450(23%) | 3414(47%) |
| Cmax(ng/mL) | 2210(33%) | 359.3(46%) |
| T1/2(h) | 6.053±1.7939 | 6.149 ± 2.2413 |
| Tmax(h) | 3.00(1.02~6.00) | 3.98(1.48~4.20) |
食物对口服吸收的影响
与空腹相比,奈玛特韦片/利托那韦片300mg/100mg与高脂餐同服后,AUC升高约20%,Cmax升高约61%。
| 参数 | 奈玛特韦片/利托那韦片 300mg/100mg(N=12) | |
|---|---|---|
| 空腹 | 餐后 | |
| AUCinf(h⋅ng/mL) | 36810(36%) | 44050(31%) |
| AUClast(h⋅ng/mL) | 35860(35%) | 43360(31%) |
| Cmax(ng/mL) | 3696(44%) | 5951(31%) |
| T1/2(h) | 8.673± 3.3768 | 7.390±2.5843 |
| Tmax(h) | 2.29(1.00~3.00) | 2.50(1.50~4.00) |
分布
健康受试者单次空腹口服奈玛特韦片/利托那韦片300mg/100mg后,奈玛特韦和利托那韦的表观分布容积VZ/F分别为109.4L、234.0L。奈玛特韦和利托那韦的人血浆蛋白结合率分别约为69%、98~99%。
代谢
体外研究表明,奈玛特韦是人MDR1(P-gp)和CYP3A的底物,非BCRP、MATE2K、OAT1、OAT3、OATP1B3和OCT2的底物。奈玛特韦主要由CYP3A4代谢,能可逆性和时间依赖性地抑制CYP3A4和MDR1。在临床相关浓度下,奈玛特韦对其它CYP酶无诱导作用,对CYP2D6、CYP2C9、CYP2C19、CYP2C8或CYP1A2无可逆性抑制作用。
人肝微粒体进行的体外研究表明,利托那韦主要是CYP3A的底物,同时也是CYP2D6的底物,CYP2D6参与了异丙噻唑氧化代谢物(M-2)的形成。利托那韦对CYP3A具有抑制作用,对CYP2D6的抑制作用弱于CYP3A。
利托那韦与奈玛特韦联用时,能够抑制奈玛特韦的代谢。奈玛特韦在血浆中主要以原型存在,排泄物(尿液和粪便)存在少量的水解代谢产物M5(12.1%)和M8(4.2%)。
消除
与利托那韦联用时,奈玛特韦主要以原型经肾脏排泄。健康受试者单次空腹口服奈玛特韦混悬剂/利托那韦片300mg/100mg后,尿液和粪便中的排泄量分别为剂量的49.6%、35.3%。
使用14C放射性同位素标记的利托那韦人体研究显示利托那韦主要经肝胆系统清除。粪便中可回收大约86%的放射性同位素标记物,包括部分未被吸收的利托那韦。
尚未考察年龄、体重、性别对奈玛特韦/利托那韦药代动力学的影响。
儿科人群
尚未在年龄<18岁的受试者中开展临床研究。
种族
单次空腹口服奈玛特韦片/利托那韦片300mg/100mg后,中国健康受试者的奈玛特韦系统暴露高于非中国人群,AUC12升高约14%,Cmax升高约39%。多次空腹口服奈玛特韦片/利托那韦片300mg/100mg后,中国健康受试者的奈玛特韦稳态系统暴露低于非中国人群,AUCtau降低约4%,Cmax降低约4%。
| 参数 | 中国人群(N=14) | 非中国人群(N=12/11) |
|---|---|---|
| 单次给药 | ||
| 体重(kg) | 62.0(54.3~79.0) | 78.1(60.6~99.9) |
| AUCtau(μg⋅hr/mL) | 19.66(26) | 17.26(26) |
| Cmax(μg/mL) | 3.082(29) | 2.210(33) |
| Tmax(h) | 1.76(1.00~4.00) | 3.00(1.02~6.00) |
| 稳态 | ||
| 体重(kg) | 62.0(54.3~79.0) | 80.2(60.7~101.0) |
| AUCtau(μg⋅hr/mL) | 32.01(21) | 33.35(20) |
| Cmax(μg/mL) | 4.500(14) | 4.678(17) |
| T1/2(h) | 6.842±1.2336 | 8.255±1.9465 |
| Tmax(h) | 2.00(1.00~4.02) | 1.02(0.500~2.08) |
| CL/F(L/hr) | 9.379(21) | 8.990(20) |
| Vz/F(L) | 91.01(29) | 104.70(33) |
肾功能不全患者
奈玛特韦的暴露量随着肾功能不全严重程度的增加而增加。
单次空腹口服奈玛特韦片/利托那韦片100mg/100mg后,与肾功能正常受试者相比,轻度(eGFR ≥60至<90mL/min)、中度(eGFR ≥30至<60mL/min)、重度肾功能不全(eGFR<30mL/min)受试者的AUCinf增加约24%、87%、204%,Cmax增加约30%、38%、48%。
| 参数 | 肾功能正常 (N=10) | 轻度肾功能不全 (N=8) | 中度肾功能不全 (N=8) | 重度肾功能不全 (N=8) |
|---|---|---|---|---|
| AUCinf(h⋅ng/mL) | 14460(20%) | 17910(30%) | 27110(27%) | 44040(33%) |
| AUClast(h⋅ng/mL) | 14270(20%) | 17770(30%) | 26660(21%) | 39420(28%) |
| Cmax(ng/mL) | 1600(31%) | 2077(29%) | 2210(17%) | 2369(38%) |
| T1/2(h) | 7.725±1.8234 | 6.606±1.5344 | 9.948±3.4171 | 13.37±3.3225 |
| Tmax(h) | 2.000 (1.00~4.00) | 2.000 (1.00~3.00) | 2.500 (1.00~6.00) | 3.000 (1.00~6.05) |
肝功能不全患者
尚未在重度肝功能不全受试者中开展临床研究。
单次空腹口服奈玛特韦片/利托那韦片100mg/100mg后,与肝功能正常受试者相比,中度肝功能不全(Child-Pugh Class B)受试者的血浆奈玛特韦的暴露(AUCinf、Cmax)与健康受试者的暴露相当。
| 参数 | 肝功能正常 (N=8) | 中度肝功能不全 (N=8) |
|---|---|---|
| AUCinf (h⋅ng/mL) | 15280(36%) | 15070(43%) |
| Cmax (ng/mL) | 1890(20%) | 1920(48%) |
| T1/2 (h) | 7(29) | 5.5(32) |
| Tmax (h) | 2(0.5~2) | 1.5(1~2) |
| 相关临床诊疗决定、药物调整方案需由医师根据患者情况独立作出,本网页信息仅供学术交流及参考。 |
- 利托那韦是CYP450酶的抑制剂,尤其是CYP3A4,同时也较小程度地抑制CYP2D6。
- 利托那韦还可以较弱程度地诱导其他CYP450酶,在和其他药物联合给药时,导致其他药物的浓度降低。
- 利托那韦对P-糖蛋白存在初期的抑制作用和后期的诱导作用,所以它的DDI不可预测。
- 在临床相关浓度下,奈玛特韦在体外不抑制CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19或CYP2D6,但它抑制CYP3A4和P-糖蛋白
- 奈玛特韦/利托那韦本身也是CYP450酶的底物,其他强效酶诱导剂可使其失效。
- 奈玛特韦/利托那韦对OATP1B1有较弱的抑制作用,可导致相关的DDIs。
* P-糖蛋白:肠、肝和肾上皮细胞中的一种外排泵,可促进药物的转运
*OATP1B1:有机阴离子转运蛋白多肽,是一种在肝脏血窦面表达的摄取转运蛋白,负责某些药物的肝摄取




| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 阿司匹林 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 氯吡格雷 | 降低 | 增加血栓形成风险 | 近期PCI或高风险PCI病史:避免使用奈玛特韦/利托那韦或在使用时改用负荷剂量的普拉格雷。其他患者:可安全地同奈玛特韦/利托那韦进行联用 |
| 普拉格雷 | 降低但不影响临床效果 | 无 | 可以安全地与奈玛特韦/利托那韦进行联用 |
| 替格瑞洛 | 增加 | 出血风险增加 | 避免使用奈玛特韦/利托那韦或在使用奈玛特韦/利托那韦时改用负荷剂量的普拉格雷。 |
a. 这里只列出常用药物,绝不是所有心血管药物的详尽清单。
- 阿司匹林:其通过与肝脏中的甘氨酸或葡萄糖醛酸结合而代谢。利托那韦微弱地诱导葡萄糖醛酸化,理论上会增加阿司匹林的代谢。然而,并没有临床不良事件的报告,因此阿司匹林可以与奈玛特韦/利托那韦联用。
- 普拉格雷**:其经过CYP3A4和CYP2B6的活化后起效。虽然利托那韦将普拉格雷的Cmax降低了2倍,但并不影响其抗血小板活性。所以接受奈玛特韦/利托那韦治疗的患者可以继续使用普拉格雷。
- 坎格瑞洛:它的代谢不涉及CYP450酶,因此奈玛特韦/利托那韦可以与坎格瑞洛联用。
- 氯吡格雷和替格瑞洛:利托那韦会减少氯吡格雷的活性代谢产物,使浓度-时间曲线下面积(AUC)减少51%,血小板抑制减少20%。替格瑞洛是一种CYP3A4底物,因此奈玛特韦/利托那韦合用会增加出血风险。除非患者服用的氯吡格雷或替格瑞洛可以被普拉格雷替代,否则临床医生应避免向此类患者开具奈玛特韦/利托那韦处方。另外,对于近期(6个月内)接受过PCI手术的且正在服用氯吡格雷或替格瑞洛的患者,或接受过高风险PCI*的患者,除非可以从负荷剂量开始替换为普拉格雷,否则不要处方奈玛特韦/利托那韦。
*高风险PCI:无保护的左主干或近端左前降支支架,支架内血栓形成史、最后一根通畅血管的介入治疗、左心室射血分数<35% 或复杂的3支血管疾病。
**普拉格雷的禁忌症包括:既往短暂性脑缺血发作/中风、年龄≥75 岁和体重<60 公斤;该产品尚未在国内上市,相关信息来源于科学文献,仅供学术探讨。
我们对更多讨论奈玛特韦/利托那韦与抗血小板药物相互作用的文献信息进行总结并撰写了医学综述。如果您想了解详细内容,可以点击链接查看该文档
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 阿哌沙班c | 增加 | 出血风险增加 | 如果患者正在进行透析,则无法安全调整/中断:避免使用奈玛特韦/利托那韦,考虑替代疗法b 对于 AF: 如果服用 5mg 阿哌沙班,每天两次:开始奈玛特韦/利托那韦并将剂量减少至 2.5 mg,每天两次,8天后恢复既往剂量使用阿哌沙班。 如果每天两次服用 2.5mg 阿哌沙班:避免使用奈玛特韦/利托那韦或停用阿哌沙班 12-24 小时,然后再开始使用奈玛特韦/利托那韦以及替代 AC(例如,依诺肝素),8天后恢复既往剂量使用阿哌沙班。 对于 VTE: 如果服用 10mg 阿哌沙班,每天两次:开始奈玛特韦/利托那韦并将阿哌沙班减至 5mg,每天两次,8天后恢复既往剂量使用阿哌沙班。 如果服用 5mg 阿哌沙班,每天两次:开始奈玛特韦/利托那韦并将阿哌沙班减至 2.5mg,每天两次,8天后恢复既往剂量使用阿哌沙班。 如果每天两次服用 2.5mg 阿哌沙班用于 VTE 预防:可以在服用奈玛特韦/利托那韦时继续相同的剂量。 |
| 利伐沙班c | 增加 | 出血风险增加 | 无法安全调整/中断:避免使用奈玛特韦/利托那韦。考虑替代疗法b 其他患者:在开始奈玛特韦/利托那韦之前停用利伐沙班 24-36 小时。使用替代 AC(例如,依诺肝素),8天后恢复利伐沙班。 |
| 依度沙班c | 增加 | 出血风险增加 | 无法安全调整或中断:避免使用奈玛特韦/利托那韦。考虑替代疗法b 如果每天服用 60mg 依度沙班:从使用奈玛特韦/利托那韦开始共计 8 天,剂量减少 50%,8天后恢复既往剂量使用依度沙班。 如果每天服用 30mg 依度沙班:开始接受奈玛特韦/利托那韦治疗时停用依度沙班。使用替代 AC(例如,依诺肝素),8天后恢复使用依度沙班。 |
| 达比加群c | 增加 | 出血风险增加 | 无法安全调整/中断:避免使用奈玛特韦/利托那韦。考虑替代疗法b 对于 AF: CrCl >50mL/min:从使用奈玛特韦/利托那韦开始,将剂量减至 110mg,每天两次,8天后恢复既往剂量使用达比加群。 CrCl 30-50mL/min:从使用奈玛特韦/利托那韦开始,将剂量减少至 75mg,每天两次,8天后恢复既往剂量使用达比加群。 CrCl <30mL/min:避免使用奈玛特韦/利托那韦与达比加群的共同给药;考虑切换到替代 AC。 对于 VTE: 如果每天两次服用 150mg 达比加群:不推荐与奈玛特韦/利托那韦联合给药。停用达比加群 12-24 小时,然后用替代 AC(例如,依诺肝素)联合奈玛特韦/利托那韦治疗,8天后恢复既往剂量使用达比加群。 |
| 华法林 | 增加或减少 (最有可能减少) | 对血栓形成和出血风险的影响不同 | 可以在密切监测 INR 的情况下联用奈玛特韦/利托那韦。 |
| 依诺肝素 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用。 |
a.这里只列出常用药物,绝不是所有心血管药物的详尽清单。
b.在筛查DDI 后,可以根据临床情况考虑使用使用其他有效药物。
c.仅对血栓栓塞低风险人群,会考虑不进行其他药物替代,直接中断口服抗凝药。低血栓栓塞风险:CHA2DS2-VASc <3 和/或无中风病史、最近一次发生静脉血栓栓塞症超过1年、无复发性血栓病史,无严重血栓形成史。对于停药必须十分谨慎,因为COVID-19感染本身可能会增加血栓栓塞的风险。
- 普通肝素和低分子肝素:不被CYP450酶代谢,可与奈玛特韦/利托那韦联用。
- 华法林:会被各种CYP450酶以不同方式代谢,其S-对映体由CYP2C9代谢,其R-对映体由CYP3A4和CYP1A2代谢。利托那韦会抑制CYP3A4 但诱导其他2种酶。利托那韦期初会引起CYP抑制,约一周后开始诱导CYP。由于奈玛特韦/利托那韦的疗程较短,因此更有可能导致国际标准化比值(INR)降低,需要经常监测INR。
- 阿哌沙班:是CYP3A4和P-糖蛋白的底物,与奈玛特韦/利托那韦联用时会增加出血风险。
- 对于每天两次服用10mg或5mg的患者,当与利托那韦共同给药时,剂量应减少 50%。
- 对于每天两次服用2.5mg以预防长期静脉血栓栓塞(VTE)的患者,可以维持剂量不变。
- 对于每天两次服用2.5mg治疗房颤的患者(AF),建议个案管理。
- 对于血栓形成风险高的患者,应在停用阿哌沙班12-24小时后开始使用奈玛特韦/利托那韦,同时使用替代抗凝剂,如依诺肝素,并在奈玛特韦/利托那韦治疗完成后继续替代抗凝治疗3天,才可重新启动阿哌沙班治疗。
- 利伐沙班:其代谢和排泄涉及CYP3A4、CYP2J2和P-糖蛋白。在使用利托那韦时,利伐沙班的AUC随时间推移增加到153%。因此,应避免利伐沙班和奈玛特韦/利托那韦的联用。如需奈玛特韦/利托那韦治疗,应在停用利伐沙班24-36小时后可同时使用奈玛特韦/利托那韦和替代抗凝剂(如依诺肝素),并在奈玛特韦/利托那韦治疗完成后继续替代抗凝治疗3天,才可重新启动利伐沙班治疗。
- 依度沙班:是P-糖蛋白的底物。利托那韦可能增加依度沙班的浓度。
- 对于每天服用60mg依度沙班治疗房颤的患者,从接受奈玛特韦/利托那韦治疗开始,共计8天,剂量可减少50%。
- 对于每天服用30mg依度沙班的患者,可在服用奈玛特韦/利托那韦的同时改用另一种抗凝剂,如依诺肝素。
- 对于使用依度沙班治疗急性或近期VTE的患者,开始接受奈玛特韦/利托那韦治疗时应停用依度沙班并同时使用依诺肝素,持续8天。结束奈玛特韦/利托那韦治疗后3天才可重新启动依度沙班治疗。
- 达比加群:是P-糖蛋白的底物,当其与利托那韦联合给药时,达比加群的Cmax和AUC分别增加133%和95%。
- 在没有肾功能障碍的情况下,当达比加群与利托那韦共同给药时无需调整剂量。
- 如果肌酐清除率(CrCl)<30mL/min,奈玛特韦/利托那韦不应与达比加群联用。
- 对于房颤和CrCl在30-50mL/min的患者,剂量可以减少到75mg,每天两次,并持续总共8天,然后以既往剂量恢复达比加群给药。
- 如果肌酐清除率(CrCl)>50mL/min,与奈玛特韦/利托那韦联用,达比加群剂量可减至110mg,每天两次。
- 对于VTE:接受150mg达比加群每日两次给药的患者,不建议与奈玛特韦/利托那韦联用。停用达比加群12-24小时,然后用替代AC(例如依诺肝素)开始奈玛特韦/利托那韦治疗共8天,然后以既往剂量重新开始达比加群治疗。
- 当口服抗凝药物不能中断或调整剂量时,不应给予奈玛特韦/利托那韦治疗。
我们对更多讨论奈玛特韦/利托那韦与抗凝血药物相互作用的文献信息进行总结并撰写了医学综述。如果您想了解详细内容,可以点击链接查看该文档。
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 阿托伐他汀 | 增加 | 肌病加重,肝毒性 | 服用奈玛特韦/利托那韦时停用阿托伐他汀。可在最后一次奈玛特韦/利托那韦给药后 3 天恢复。若要和奈玛特韦/利托那韦进行联用,可以使用每天10毫克的较低剂量 |
| 瑞舒伐他汀 | 增加 | 肌病加重,肝毒性 | 服用奈玛特韦/利托那韦时停用瑞舒伐他汀。可以在最后一次奈玛特韦/利托那韦给药后的第2天恢复。若要和奈玛特韦/利托那韦进行联用,日最大剂量可以用到10mg |
| 辛伐他汀 | 增加 | 肌病加重,肝毒性 | 奈玛特韦/利托那韦首次给药前 12 小时停用辛伐他汀。可以在最后一剂奈玛特韦/利托那韦后 5 天恢复。 |
| 洛伐他汀 | 增加 | 肌病加重,肝毒性 | 奈玛特韦/利托那韦首次给药前 12 小时停用洛伐他汀。可以在最后一剂奈玛特韦/利托那韦后 5 天恢复。 |
| 普伐他汀 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 氟伐他汀 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 匹伐他汀 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 依折麦布 | 减少 | 疗效下降 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 贝特类 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 依洛尤单抗 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 阿利西尤单抗 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
a.这里只列出常用药物,绝不是所有心血管药物的详尽清单。
- 辛伐他汀和洛伐他汀:和利托那韦/沙奎那韦共同给药会使辛伐他汀24小时AUC增加3059%。因此与奈玛特韦/利托那韦联合给药存在肌病和横纹肌溶解的风险,建议奈玛特韦/利托那韦不应与辛伐他汀或洛伐他汀一起使用。在奈玛特韦/利托那韦治疗开始前12小时停止辛伐他汀/洛伐他汀的使用,并在治疗完成后3-5天才能重新启动。
- 匹伐他汀、氟伐他汀和普伐他汀:匹伐他汀主要通过葡萄糖醛酸化作用代谢。尽管利托那韦会诱导葡萄糖醛酸化并在理论上降低匹伐他汀水平,但匹伐他汀与达芦那韦/利托那韦之间没有显着的相互作用。氟伐他汀通过CYP2C9和CYP2C8代谢。虽然利托那韦诱导CYP2C9,但奈玛特韦/利托那韦都不影响CYP2C8。当接受奈玛特韦/利托那韦治疗的同时必须继续使用他汀类药物,可以考虑氟伐他汀、匹伐他汀和普伐他汀,因为它们的代谢不涉及CYP3A4。
- 瑞舒伐他汀:主要通过CYP2C9代谢。和利托那韦联用会使瑞舒伐他汀的浓度提高3倍,但机制尚不清楚。若患者接受奈玛特韦/利托那韦治疗,则可以选择停用瑞舒伐他汀或每日剂量不超过10mg。
- 依折麦布和贝特类:这两类药物可以安全地和利托那韦联合使用。
- 单克隆抗体和siRNA药物:这两类药物主要通过肝脏和网状内皮系统中的蛋白水解进行代谢,通常没有显著的DDI,可以安全地和利托那韦联合使用。
我们对更多讨论奈玛特韦/利托那韦与降脂类药物相互作用的文献信息进行总结并撰写了医学综述。如果您想了解详细内容,可以点击链接查看该文档。
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 美托洛尔、普萘洛尔、卡维地洛、阿替洛尔、艾司洛尔 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 拉贝洛尔 | 降低 | 降低降压作用 | 可以将奈玛特韦/利托那韦与家庭血压监测联合使用。 |
| 硝酸盐 | 降低 | 效果减弱 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 雷诺嗪 | 增加 | QT 间期延长 尖端扭转型室性心动过速 | 避免同时服用奈玛特韦/利托那韦或在使用奈玛特韦/利托那韦时暂时停用雷诺嗪。 |
a.这里只列出常用药物,绝不是所有心血管药物的详尽清单。
- β受体阻滞剂:
- 虽然由肝脏代谢的β受体阻滞剂,如美托洛尔、普萘洛尔、卡维地洛等是CYP2D6底物,但当他们与利托那韦一起给药时,并不会导致临床DDI。
- 阿替洛尔以原形经肾脏排泄,艾司洛尔在红细胞中代谢,因此,同时使用CYP450或P-糖蛋白抑制剂,如奈玛特韦/利托那韦不会影响两者的疗效。
- 拉贝洛尔的主要代谢途径是葡萄糖醛酸化。利托那韦可能会降低拉贝洛尔的浓度。由于利托那韦对尿苷二磷酸-葡萄糖醛酸转移酶的诱导作用有延迟,因此 在密切监测血压的前提下,拉贝洛尔可以安全地和奈玛特韦/利托那韦联用。
- 硝酸酯类药物:硝酸异山梨酯和单硝酸异山梨酯作为底物和CYP3A4反应可得到活性代谢物一氧化氮。当上述两种药品和奈玛特韦/利托那韦联用时可能会降低前者的临床效果,但尚未进行研究,该类药物在联用时无需调整剂量。
- 雷诺嗪:是CYP3A4和P-糖蛋白的底物。CYP450抑制剂会导致其血浆浓度呈指数增加,从而增加QT间期延长和尖端扭转型室性心动过速的风险。因此, 该药物禁忌和奈玛特韦/利托那韦共同给药。
我们对更多讨论奈玛特韦/利托那韦与抗心绞痛药物相互作用的文献信息进行总结并撰写了医学综述。如果您想了解详细内容,可以点击链接查看该文档。
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 赖诺普利、依那普利、喹那普利、卡托普利 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 厄贝沙坦 | 减少 | 降低抗高血压作用 | 可安全地同奈玛特韦/利托那韦进行联用;药物相互作用相对温和。血压监测可能会有帮助。 |
| 氯沙坦 | 增加 | 低血压 | 可安全地同奈玛特韦/利托那韦进行联用;药物相互作用相对温和。血压监测可能会有帮助。 |
| 缬沙坦 | 增加 | 低血压 | 在血压监测下可安全地同奈玛特韦/利托那韦进行联用。如果随后发生低血压,则停止缬沙坦。 |
| 沙库巴曲/缬沙坦 | 增加 | 低血压 | 在血压监测下可安全地同奈玛特韦/利托那韦进行联用。如果随后发生低血压,停止沙库巴曲/缬沙坦。 |
| 坎地沙坦 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 替米沙坦 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 奥美沙坦 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 螺内酯 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 依普利酮 | 增加 | 高钾血症 | 在服用奈玛特韦/利托那韦时避免联合用药并暂时停用依普利酮。 |
| 卡格列净 | 减少 | 降低血糖控制 | 可安全地同奈玛特韦/利托那韦进行联用,因为奈玛特韦/利托那韦的处方时间很短。 |
| 恩格列净 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 达格列净 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 伊伐布雷定 | 增加 | 心动过缓 | 在使用奈玛特韦/利托那韦时避免共同给药或暂时停用伊伐布雷定。 |
| 地高辛 | 增加 | 毒性水平 | 根据患者的肾功能,可建议减少剂量;地高辛浓度监测需要格外关注;或者在使用奈玛特韦/利托那韦时可以暂时停用地高辛。 |
| 呋塞米 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 托拉塞米 | 轻度减少 | 无 | 弱相互作用,因此可安全地同奈玛特韦/利托那韦进行联用 |
| 氢氯噻嗪、美托拉宗、氯噻酮 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
a.这里只列出常用药物,绝不是所有心血管药物的详尽清单。
- 血管紧张素转换酶抑制剂:如赖诺普利、依那普利、喹那普利和卡托普利,在尿液中以原形排出,与奈玛特韦/利托那韦没有显著相互作用,因此可以安全地联用。
- 血管紧张素Ⅱ受体拮抗剂:
- 利托那韦可轻微诱导CYP2C9,从而降低厄贝沙坦的降压作用。
- 氯沙坦通过CYP2C9代谢会产生活性代谢物,因此氯沙坦与奈玛特韦/利托那韦联用可导致低血压。不过由于利托那韦的诱导作用有延迟,因此不建议调整剂量。
- 奈玛特韦/利托那韦对肝摄取转运蛋白OATP1B1的弱抑制作用,可能会增加缬沙坦和沙库巴曲活性代谢物的浓度,需要密切监测血压。出于这个原因,我们可能会考虑在使用奈玛特韦/利托那韦时暂时停用沙库巴曲/缬沙坦。
- 坎地沙坦和奥美沙坦以原型药的形式从尿液中排出,并且不与奈玛特韦/利托那韦发生药物药物相互作用。
- 替米沙坦不被CYP450酶代谢,因此不与奈玛特韦/利托那韦发生药物药物相互作用。
- 阿齐沙坦主要由CYP2C9代谢。利托那韦理论上可以降低阿齐沙坦的血浆水平,但临床相关性尚未知。
- 螺内酯:会被单加氧酶代谢为含硫活性代谢产物。该药物与奈玛特韦/利托那韦缺乏重叠的代谢途径,因此不太可能产生药物药物相互作用。
- 依普利酮:主要通过CYP3A4消除,使用该药的同时给予奈玛特韦/利托那韦会显着增加高钾血症的风险,因此,该药物禁忌和奈玛特韦/利托那韦共同给药。
- SGLT2is类药物:钠-葡萄糖协同转运蛋白2抑制剂 (SGLT2is) 的代谢依赖于肝脏中的UGT。利托那韦作为UGT的诱导剂可降低所有SGLT2is的血浆水平。
- 理论上,当与利托那韦合用时,卡格列净的剂量应从100mg增加到300mg。不过鉴于奈玛特韦/利托那韦治疗时间持续较短,因此无需调整剂量。
- 恩格列净虽然也是P-糖蛋白和OATP1B1的底物,但未见临床相关作用,因此无需调整剂量。
- 达格列净也同样无需调整剂量。
- 伊伐布雷定:是一种CYP3A4底物。当与奈玛特韦/利托那韦联用时,预计会出现明显的心动过缓,因此在患者接受奈玛特韦/利托那韦治疗前应停用伊伐布雷定;若因安全问题无法暂时停用伊伐布雷定,则应避免使用奈玛特韦/利托那韦的使用。
- 地高辛:是P-糖蛋白的底物。利托那韦将其肾脏和非肾脏清除率分别降低35%和48%。当其与奈玛特韦/利托那韦联用时,建议根据肾功能将剂量减少30-50%或中断治疗,同时密切监测。
- 呋塞米、氢氯噻嗪、美托拉宗、氯噻酮和托塞米:呋塞米在肾脏和肝脏中进行葡萄糖醛酸化,但大部分以原形从尿液中排出。氢氯噻嗪、美托拉宗和氯噻酮也主要通过原型药排出。上述药品均可安全地和奈玛特韦/利托那韦联用。托塞米主要通过CYP2C9代谢,但因为利托那韦的诱导作用有延迟,因此无需对托拉塞米进行剂量调整。
我们对更多讨论奈玛特韦/利托那韦与心力衰竭治疗药物相互作用的文献信息进行总结并撰写了医学综述。如果您想了解详细内容,可以点击链接查看该文档。
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 氨氯地平 | 增加 | 低血压、潮红和水肿 | 开始接受奈玛特韦/利托那韦治疗时,建议将氨氯地平的剂量减少 50%,持续 8 天。 |
| 硝苯地平、非洛地平 | 增加 | 低血压、潮红和水肿 | 如果与奈玛特韦/利托那韦共同给药,则关闭血压监测和/或减少剂量。如有需要可暂时停止。可以在最后一剂奈玛特韦/利托那韦后 3 天重新开始。 |
| 地尔硫卓、维拉帕米 | 增加 | 心动过缓、头晕、低血压、水肿 | 如果与奈玛特韦/利托那韦共同给药,则关闭血压监测和/或减少剂量。如有需要可暂时停止。可以在最后一剂奈玛特韦/利托那韦后 3 天重新开始。 |
| 多沙唑嗪/特拉唑嗪 | 增加 | 低血压 | 在使用奈玛特韦/利托那韦时关闭血压监测或暂时停药。 |
a.这里只列出常用药物,绝不是所有心血管药物的详尽清单。
- 钙离子拮抗剂:
- 氨氯地平、硝苯地平和非洛地平通过CYP3A4代谢。有研究表明,联用茚地那韦/利托那韦时,氨氯地平浓度升高了约2倍,因此患者开始接受奈玛特韦/利托那韦治疗时,建议将氨氯地平的剂量减少50%,持续 8 天,并密切监测低血压、潮红和水肿等副作用,这些副作用可能导致需要暂时停药,直到利托那韦的抑制作用完全消失(约最后一次给药后 3 天)。
- 地尔硫卓和维拉帕米通过CYP3A4和CYP2D6代谢。联用茚地那韦/利托那韦时,使地尔硫卓的AUC增加26.5%。因此,与奈玛特韦/利托那韦联用时,建议密切监测可能需要暂时停药的不良反应,如心动过缓、头晕和低血压。
- α受体阻滞剂:多沙唑嗪和特拉唑嗪等通过CYP3A4代谢,和奈玛特韦/利托那韦联用可升高前者的血浆浓度进而引发低血压。因此,建议密切监测或暂时停药。由于存在严重低血压的风险,阿夫唑嗪禁忌和奈玛特韦/利托那韦共同给药。
我们对更多讨论奈玛特韦/利托那韦与降压药物相互作用的文献信息进行总结并撰写了医学综述。如果您想了解详细内容,可以点击链接查看该文档。
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 胺碘酮、多非利特、氟卡尼、决奈达隆、普罗帕酮、奎尼丁 | 增加 | 危及生命的心律失常 | 禁止奈玛特韦/利托那韦的联用。考虑其他 COVID-19 疗法或在可行的情况下考虑暂时停止抗心律失常治疗。 胺碘酮的半衰期约 100 天,无法选择停药和启动奈玛特韦/利托那韦的治疗方案。 |
| 索他洛尔 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
a.这里只列出常用药物,绝不是所有心血管药物的详尽清单。
- 胺碘酮、多非利特、决奈达隆和奎尼丁通过CYP3A4代谢,氟卡尼通过CYP2D6代谢,普罗帕酮主要通过CYP2D6代谢,少部分经由CYP3A4 代谢。由于和利托那韦的联用会导致危及生命的心律失常风险增加,因此禁止利托那韦与上述药物联用。
- 索他洛尔通过肾脏清除,因此它和奈玛特韦/利托那韦的联用是安全的。
- 若患者正在使用多非利特、普罗帕酮和奎尼丁等半衰期相对较短的药物,同时又必须使用奈玛特韦/利托那韦进行治疗,建议在开始奈玛特韦/利托那韦治疗前停药2-2.5天(4-5个半衰期)。不过上述方法可能并不切实际,因为停药会有心律失常复发的风险,需要住院治疗,重新启用抗心律失常药,另外奈玛特韦/利托那韦治疗需要等待停药后几天,进一步降低了上述药物的有效性。
- 因为氟卡尼、决奈达隆或胺碘酮的消除时间超过5天,超过此时间奈玛特韦/利托那韦的治疗可能会无效,所以中断上述药物治疗的方案也是不可行的,对于上述药物应避免和奈玛特韦/利托那韦联用。
我们对更多讨论奈玛特韦/利托那韦与抗心律失常药物相互作用的文献信息进行总结并撰写了医学综述。如果您想了解详细内容,可以点击链接查看该文档。
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 肺动脉高压治疗 | |||
| 安贝生坦 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 波生坦 | 增加 | 头痛、恶心、呕吐、肝毒性 | 禁止与奈玛特韦/利托那韦联用。在开始奈玛特韦/利托那韦治疗前至少停药 36 小时。 |
| 马西腾坦 | 增加 | 头痛、恶心、呕吐、肝毒性 | 不建议与奈玛特韦/利托那韦联用。在开始奈玛特韦/利托那韦治疗前至少停药 36 小时。 |
| 西地那非 | 增加 | 低血压、持续勃起、视力障碍 | 不要与奈玛特韦/利托那韦联用。 |
| 他达拉非 | 增加 | 低血压、持续勃起、视力障碍 | 不要与奈玛特韦/利托那韦联用。 |
| 前列环素类似物 | |||
| 司来帕格 | 无 | 无 | 可安全地同奈玛特韦/利托那韦进行联用 |
| 利奥西呱 | 增加 | 无 | 将利奥西呱的剂量减少至 0.5mg,每天 3 次,同时联合使用奈玛特韦/利托那韦并密切监测副作用。 |
a.这里只列出常用药物,绝不是所有心血管药物的详尽清单。
- 内皮素受体拮抗剂(ERA):
- 安贝生坦可以安全地与奈玛特韦/利托那韦联用。安贝生坦它主要通过葡萄糖醛酸化代谢,尽管它在一定程度上也可作为OATP1B1、P-糖蛋白和CYP3A4的底物,但并未发现其与利托那韦有临床相关的药物相互作用。
- 波生坦通过CYP2C9和CYP3A4代谢,生成活性代谢产物,并通过OATP排泄到胆汁中。当其与洛匹那韦/利托那韦联用时,其浓度升高48倍。因此,禁止波生坦和奈玛特韦/利托那韦的联用。在患者接受奈玛特韦/利托那韦治疗之前,应停用波生坦至少36小时。
- 马昔腾坦的肝摄取不依赖于OATP,但马昔腾坦会抑制CYP3A4,因此,建议不要将马昔腾坦与强CYP抑制剂(如利托那韦)联用。
- 磷酸二酯酶-5抑制剂:利托那韦使西地那非的AUC和Cmax分别增加11倍和3.9倍,会导致勃起时间延长、低血压、视力模糊和晕厥。同时使他达拉非的AUC增加124%。因此禁止奈玛特韦/利托那韦和磷酸二酯酶-5抑制剂联用(如西地那非和他达拉非)。
- 前列环素类似物:伊洛前列素、曲前列尼尔和依前列醇可以安全地与奈玛特韦/利托那韦联用。
- 伊洛前列素主要通过羧基侧链的β-氧化代谢,依前列醇在血液中迅速水解并被酶促降解,它们都不是CYP450底物。
- 曲前列尼尔主要经由CYP2C8代谢,少量经由CYP2C9代谢,由于利托那韦抑制CYP2C8并诱导CYP2C9,因此它对曲前列尼尔的总体影响很小。
- 前列环素受体激动剂:虽然司来帕格经由CYP3A4代谢。但据研究,其与洛匹那韦/利托那韦联用时,药代动力学可能不会受到临床程度的影响,因此,司来帕格可以安全地与奈玛特韦/利托那韦联用。
- 可溶性鸟苷酸环化酶刺激剂:利奥西呱经由CYP3A4和P-糖蛋白代谢。因可能与利托那韦发生药物相互作用,建议在使用奈玛特韦/利托那韦治疗时将利奥西呱的剂量减少至0.5mg,每天3次,并密切监测是否出现低血压。
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 秋水仙碱 | 增加 | 毒性水平 | 避免同时服用奈玛特韦/利托那韦或在使用奈玛特韦/利托那韦时暂时停用秋水仙碱。 |
| 地塞米松 | 增加 | 库欣综合征,肾上腺抑制 | 服用奈玛特韦/利托那韦时将剂量减少至 50%,并在奈玛特韦/利托那韦治疗结束后 3 天恢复全剂量;考虑改用泼尼松龙或倍氯米松。 |
| 甲泼尼龙 | 增加 | 库欣综合征,肾上腺抑制 | 联用需持续关注并监测副作用。考虑改用泼尼松龙或倍氯米松。 |
| 强的松 | 增加 | 库欣综合征,肾上腺抑制 | 联用需持续关注并监测副作用。考虑改用泼尼松龙或倍氯米松。 |
| 泼尼松龙 | 无 | 奈玛特韦/利托那韦持续时间短无临床显著影响 | 可安全地同奈玛特韦/利托那韦进行联用 |
a.这里只列出常用药物,绝不是所有心血管药物的详尽清单。
- 秋水仙碱:经由CYP3A4和P-糖蛋白代谢,经胆汁和肾脏排泄。利托那韦使秋水仙碱的Cmax和AUC分别增加2.7倍和3.5倍,因此不应将秋水仙碱和奈玛特韦/利托那韦联用。
- 皮质类固醇:
- 地塞米松是一种CYP3A4底物。在唑类药物的共同给药期间,其AUC增加2.6倍,并可能会导致库欣综合征和肾上腺功能不全。预计联用奈玛特韦/利托那韦也会产生类似效果,因此建议在联用奈玛特韦/利托那韦时将地塞米松的剂量降至50%,并在奈玛特韦/利托那韦治疗完成3天后恢复常规剂量地塞米松给药。
- 甲泼尼龙和强的松也有类似的效果。建议患者改用和奈玛特韦/利托那韦相互作用较少的泼尼松龙或倍氯米松。
- 总体而言,库欣综合征等副作用因为奈玛特韦/利托那韦治疗持续时间较短而发生率相对较低。
| 药物a | 奈玛特韦/利托那韦对药物浓度的影响 | 相互作用的影响 | 推荐 |
|---|---|---|---|
| 环孢菌素 | 增加 | 毒性水平 | 不建议在这些患者中使用奈玛特韦/利托那韦d。 |
| 他克莫司 | 增加 | 毒性水平 | 不建议在这些患者中使用奈玛特韦/利托那韦d。 |
| 西罗莫司 | 增加 | 毒性水平 | 不建议在这些患者中使用奈玛特韦/利托那韦d。 |
a. 这里只列出常用药物,绝不是所有心血管药物的详尽清单。
d. 若需要和奈玛特韦/利托那韦联用,则需要显著减少剂量。在奈玛特韦/利托那韦5的天疗程中,需要反复检查免疫抑制剂的药物水平。在患者感染COVID-19时很难做到,因此应考虑COVID-19的替代疗法
- 他克莫司和环孢菌素:经由CYP3A4代谢。他克莫司同时也是P-糖蛋白的底物。与利托那韦联用可导致他克莫司/环孢素的血浆浓度严重升高。
- 当患者接受奈玛特韦/利托那韦治疗时,建议停用他克莫司,并在第3天时进行他克莫司药物浓度评估。建议在完成奈玛特韦/利托那韦治疗后2周内不断监测免疫抑制剂的浓度。
- 对于环孢菌素,建议2将剂量减少至每日总剂量的80%,并考虑每日给药一次。正因为需要减少药物使用的剂量,并且需要频繁地进行药物浓度监测,给奈玛特韦/利托那韦的使用带来困难,因此不推荐在上述患者中使用奈玛特韦/利托那韦。
- 西罗莫司也是CYP3A4底物,当与奈玛特韦/利托那韦联用时,会导致药物浓度达到毒性水平。
2022年
Vaccines (Basel). 2022 Aug 28;10(9):1409. 上海
Lancet Infect Dis. 2022 Sep;22(9):1279. 上海
Paxlovid in patients who are immunocompromised and hospitalised with SARS-CoV-2 infection
Front Med (Lausanne). 2022 Sep 6;9:980002. 上海
Medicine (Baltimore). 2022 Nov 11;101(45):e31361. 贵州
Paxlovid administration in elderly patient with COVID-19 caused by Omicron BA.2.0: A case report
Emerg Microbes Infect. 2022 Dec;11(1):2045-2054. 上海
Lancet Reg Health West Pac. 2022 Dec 24;30:100671. 林芝市,西藏
Nirmatrelvir-ritonavir treatment on SARS-CoV-2 viral dynamics in high altitude habitants
2023年
Clin Infect Dis. 2023 Feb 8;76(3):e148-e154. 北京
Infect Dis Ther. 2023 Feb;12(2):649-662. 上海
J Med Virol. 2023 Feb;95(2):e28497. 上海
Influenza Other Respir Viruses. 2023 Feb;17(2):e13095. 上海
J Med Virol. 2023 Jan;95(1):e28443. 上海
Front Public Health. 2023 Jan 12;10:1087800. 上海
Factors associated with prolonged viral shedding in older patients infected with Omicron BA.2.2
J Med Virol. 2023 Feb;95(2):e28550. 上海
Front Pharmacol. 2023 Jun 5;14:1146938. 泉州市,福建
Front Med (Lausanne). 2023 Jul 13;10:1161193. 温州市,浙江
Efficacy and safety of Nirmatrelvir/Ritonavir for treating the Omicron variant of COVID-19
J Med Virol. 2023 Aug;95(8):e29014. 上海
Paxlovid reduces the risk of Long COVID in patients six months after hospital discharge
如需核心研究原文,请您联系辉瑞医学信息部: [email protected], 或通过辉瑞医学信息网站在线提问获取。
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
2.中华普通外科学文献(电子版), 2013, 7(2): 153.
3.Rolf Hilgenfeld. FEBS J, 2014, 281(18): 4085–4096.
4.Linlin Zhang, et al. Science, 2020, 368(6489): 409–412.
5.Milligan, et al. Biochem J, 2021, 478(13): 2499–2515.
6.Bhupesh Goyal, et al. ACS Comb Sci, 2020 , 22(6): 297-305.
7.Dafydd R Owen, et al. Science, 2021, 374(6575): 1586-1593.
8. Maren de Vries, et al. J Virol. 2021;95(10):e01819-20.
9. Kanchan Anand, et al. Science. 2003;300(5626):1763-7.
10. Yang H, et al. PLoS Biol. 2005;(10):e324.
11. Pluskota-Karwatka D, et al. J Pharm Anal 2021;11(4):383-97;
12. V'Kovski P, et al. Nat Rev Microbiol 2021;19(3):155-70.
13. Tian D, Liu Y, Liang C, et al. Biomed Pharmacother. 2021;137:111313.
14. Rana Abdelnabi, et al. Nat Commun. 2022;13(1):719.
15. Sven Ullrich, et al. Bioorg Med Chem Lett. 2022;62:128629.
16. Laura Vangeel, et al. Antiviral Res. 2022;198:105252.
17. Samantha E Greasley, et al. J Biol Chem. 2022;298(6):101972.
18. Takayuki Kuroda, et al. J Antimicrob Chemother. 2023;78(4):946-952.
19. Hirofumi Ohashi, et al. Antiviral Res. 2022;205:105372.
20. Emi Takashita, et al. N Engl J Med. 202;386(15):1475-1477.
21. Emi Takashita, et al. N Engl J Med, 2022, 387(5): 468-470.
22. Masaki Imai, et al. N Engl J Med. 2023;388(1):89-91.
23. Emi Takashita, et al. N Engl J Med. 2022;387(13):1236-1238.
24. Akatsuki Saito, et al. Cell Host Microbe. 2022;30(11):1540-1555.e15.
25. Emi Takashita, et al. N Engl J Med. 2022;387(22):2094-2097.
26. Abraham S,et al. J Am Coll Cardiol. 2022;80(20):1912-1924
27. Li P, Wang Y, Lavrijsen M, et al. Cell Res. 2022;32(3):322-324.
28. Cho J, Shin Y, Yang JS, et al. Antiviral Res. 2023;214:105609.
29. Uraki R, Kiso M, Iida S, et al. Nature. 2022;607(7917):119-127.
30. Pochtovyi AA, Kustova DD, Siniavin AE, et al. Vaccines (Basel). 2023;11(10):1533.
31. Rosales R, McGovern BL, Rodriguez ML, et al. Antiviral Res. 2024;230:105970.



