本品单药适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌患者的治疗。[1]
洛拉替尼分子式 [1]:C21H19FN6O2

作用机制
- 洛拉替尼为ALK、ROS1激酶抑制剂,对TYK1、FER、FPS、TRKA、TRKB、TRKC、FAK、FAK2、ACK激酶也具有体外抑制活性。洛拉替尼对ALK激酶的多种突变形式具有体外抑制活性,包括疾病进展(克唑替尼和其它ALK抑制剂治疗)时肿瘤中所检测到的一些突变。[1]
- 在EML4与ALK变体1或ALK突变体(包括在ALK抑制剂治疗后进展的肿瘤中检测到的G1202R和I1171T突变)融合的小鼠皮下移植瘤模型中,可见洛拉替尼抗肿瘤活性。洛拉替尼在EML4-ALK颅内移植瘤模型小鼠中也可见抗肿瘤活性,并可延长小鼠生存期。洛拉替尼在体内模型中的整体抗肿瘤活性呈剂量依赖性,并与抑制ALK的磷酸化相关。[1]
- 前身是克唑替尼。通过基于结构的药物设计、增加亲脂性和优化理化性质研发所得。是ALK和ROS1激酶的强效、高选择性、ATP-竞争性小分子抑制剂。规避了常见的ALK耐药突变,增加了血脑穿透性。[2]
在每日一次口服给药10mg至200mg剂量范围内(推荐剂量的0.1至2倍),稳态洛拉替尼最大血浆浓度(Cmax)按比例增加并且AUC的增加略低于药物增加比例。在推荐剂量下,癌症患者的平均[变异系数(CV)%] Cmax为577ng/mL(42%),AUC0-24h为5650ng·h/mL (39%)。与单次给药相比,洛拉替尼口服清除率在稳态下有所增加,表明存在自身诱导。[1]
患者选择
经验证的检测方法证实为ALK阳性的局部晚期或转移性NSCLC患者方可使用本品。[1]
推荐剂量
本品的推荐剂量为每日一次口服100mg(与食物同服或不同服),直至疾病进展或出现不可耐受的毒性。[1]
针对不良反应的剂量调整
推荐的剂量降低方法如下[1]:
第一次降低剂量:每日一次口服75mg
第二次降低剂量:每日一次口服50mg对于不能耐受每日一次口服50mg的患者,则永久停用本品。
针对本品不良反应的剂量调整建议[1]
表1 针对本品不良反应的剂量调整建议 不良反应a 剂量调整 中枢神经系统影响 1级 按相同剂量水平继续用药或暂停用药直到恢复至基线。以相同剂量或降低一个剂量水平继续服用本品。 2级或3级 暂停服用本品,直到恢复至0或1级。降低一个剂量水平继续服用本品。 4级 永久停用本品。 高脂血症 4级高胆固醇血症或4级高甘油三酯血症 暂停服用本品,直到高胆固醇血症和/或高甘油三酯血症恢复至2级或以下。以相同剂量继续服用本品。
- 如果重度高胆固醇血症和/或高甘油三酯血症复发,则降低一个剂量水平继续服用本品。
房室(AV)传导阻滞 二度房室传导阻滞 暂停服用本品,直到PR间期小于200ms。降低一个剂量水平继续服用本品。 首次出现完全性房室传导阻滞 暂停服用本品,直到植入起搏器或PR间期<200ms。
- 如果植入了起搏器,则以相同剂量继续服用本品。
- 如果没有植入起搏器,则降低一个剂量水平继续服用本品。
再次出现完全性房室传导阻滞 植入起搏器或永久停用本品。 间质性肺病 (ILD)/非感染性肺炎 任何级别的与治疗相关的ILD/非感染性肺炎 永久停用本品。 高血压 3级
收缩压≥160mmHg或舒张压≥100mmHg;需要进行医疗干预;需要使用一种以上的降压药物,或需要进行比以前更加强化的治疗暂停服用本品直到高血压恢复至1级或以下(收缩压<140mmHg和舒张压<90mmHg),然后以相同剂量继续服用本品。
- 如果3级高血压复发,则暂停服用本品直到高血压恢复至1级或以下,并降低一个剂量水平继续服用本品。
- 如果不能通过最佳的医疗措施有效控制高血压,则永久停用本品。
4级
危及生命,需要紧急干预暂停服用本品直到高血压恢复至1级或以下,并降低一个剂量水平继续服用本品或永久停用本品。
- 如果4级高血压复发,则永久停用本品。
高血糖 3级(尽管进行了最佳的降糖治疗,但仍大于250mg/dL)或4级 暂停服用本品直到高血糖得到充分控制,然后降低一个剂量水平继续服用本品。
- 如果不能通过最佳的医疗措施有效控制高血糖,则永久停用本品。
其他不良反应 1级或2级 以相同剂量或降低一个剂量水平继续服用本品。 3级或4级 暂停服用本品,直到症状缓解至≤2级或基线。然后降低一个剂量水平继续服用本品。 a 根据美国国家癌症研究所 (NCI) 不良事件通用术语标准(CTCAE) 4.03 版进行分级。
- 合用强效CYP3A诱导剂:
本品禁用于正在服用强效CYP3A诱导剂的患者。停用强效CYP3A诱导剂的3个血浆半衰期后,开始服用本品。[1] - 合用中效CYP3A诱导剂:
避免本品与中效CYP3A诱导剂合用。如果不能避免与中效CYP3A诱导剂合用,则应将本品剂量增加至125mg每日一次。 [1] - 针对强效CYP3A抑制剂的剂量调整:
避免本品与强效CYP3A抑制剂合用。如果不能避免与强效CYP3A抑制剂合用,则应将本品的起始剂量从每日一次口服100mg减至每日一次口服75mg。- 如患者因不良反应而将每日口服剂量减至75mg,并开始服用强效CYP3A抑制剂,则应将本品剂量减至每日一次口服50mg。
- 如果停止合用强效CYP3A抑制剂,则应将本品剂量(在停用强效CYP3A抑制剂的3个血浆半衰期后)增至开始使用强效CYP3A抑制剂之前的剂量。[1]
- 针对氟康唑的剂量调整:
避免本品与氟康唑合用。如果不能避免合用,则应将本品的起始剂量从每日一次口服100mg减至每日一次口服75mg。[1] - 肝损害
对于轻度肝损害的患者,不建议进行剂量调整(总胆红素≤正常值上限[ULN]伴AST>ULN,或者总胆红素>1至1.5×ULN伴任何AST)。尚未确定本品对于中度(总胆红素≥1.5至3.0×ULN伴任何AST)或重度(总胆红素>3.0×ULN伴任何AST)肝损害患者的推荐剂量。[1] - 肾损害
对重度(采用Cockcroft-Gault公式估算的肌酐清除率[CLcr]为15至<30mL/min)肾损害患者给予本品时应将本品的起始剂量从每日一次口服100mg减至每日一次口服75mg。[1]
对于轻度或中度肾损害(采用Cockcroft-Gault公式估算的肌酐清除率[CLcr]为30至89mL/min)的患者,不建议进行剂量调整。[1]
妊娠女性[1]
基于动物研究的发现及本品的作用机制,妊娠女性服用本品可能会造成胚胎-胎儿伤害。应告知妊娠女性对胎儿的潜在风险。
哺乳期女性[1]
由于哺乳婴儿存在发生严重不良反应的潜在可能性,因此应告知女性在接受本品治疗期间以及末次给药后至少7天内不要哺乳。
具有生育潜能的女性和男性[1]
- 妊娠检查:对于具有生育能力的女性,在开始本品给药之前检查妊娠状态。
- 避孕:妊娠女性使用本品可能会引起胚胎-胎儿伤害。
女性:应告知具有生育能力的女性患者在接受本品治疗期间及末次给药后至少6个月内使用有效的非激素避孕措施。建议具有生育能力的女性使用非激素避孕措施,因为本品可能使激素类避孕药失效。
男性:基于遗传毒性的研究结果,对于女性伴侣具有生育能力的男性,应告知在接受本品治疗期间及末次给药后至少3个月内使用有效的避孕措施。 - 不孕:基于动物研究的研究结果,本品可能会短暂损伤男性生育力。
儿童[1]
儿童患者使用本品的安全性和有效性尚未确定。
老年[1]
对于在研究B7461001(N=295)和研究B7461006(N=149)中接受100mg本品每日一次口服给药的患者中,分别有18%和40%的患者的年龄为65岁或更高。65岁或更高年龄的患者与较年轻患者之间未观察到安全性或疗效出现具有临床意义的差异。
本品禁用于正在服用强效CYP3A诱导剂的患者,因为可能发生严重肝脏毒性。停用强效CYP3A诱导剂的3个血浆半衰期后,开始服用本品。[1]
强效CYP3A诱导剂
本品与强效CYP3A诱导剂合用可使洛拉替尼血浆浓度降低,从而可能降低本品的疗效。
接受本品与利福平(一种强效CYP3A诱导剂)同时给药的健康受试者曾发生严重肝脏毒性。在12名接受100mg本品单次给药和利福平多次每日给药的健康受试者中,83%受试者发生3或4级ALT或AST升高,8%受试者发生2级ALT或AST升高。一种可能的机制是本品和利福平(两者都是PXR激动剂)对孕烷X受体的激活作用。
本品禁用于正在服用强效CYP3A诱导剂的患者。停用强效CYP3A诱导剂的3个血浆半衰期后,开始服用本品。
中效CYP3A诱导剂
本品与中效CYP3A诱导剂合用可使洛拉替尼血浆浓度降低,从而可能降低本品的疗效。避免本品与中效CYP3A诱导剂合用。如果不能避免合用,则应增加本品剂量。[1]
强效CYP3A抑制剂
与强效CYP3A抑制剂合用可使洛拉替尼血浆浓度升高,从而可能增加本品不良反应的发生率和严重程度。避免本品与强效CYP3A抑制剂合用。如果不能避免合用,则应降低本品剂量。[1]
氟康唑
本品与氟康唑合用可使洛拉替尼血浆浓度升高,从而可能增加本品不良反应的发生率和严重程度。避免本品与氟康唑合用。如果不能避免合用,则应降低本品剂量。[1]
某些CYP3A底物
本品是一种中效CYP3A诱导剂。与本品合用会降低CYP3A底物的浓度,这可能会降低这些底物的疗效。避免本品与某些CYP3A底物合用,因为底物浓度的极小改变可能会导致严重的治疗失败。
如果合用无法避免,则根据批准的产品说明书增加CYP3A底物的剂量。[1]
某些P-糖蛋白(P-gp)底物
本品是一种中效P-gp诱导剂,与本品合用会降低P-gp底物的浓度,这可能会降低这些底物的疗效。避免本品与某些P-gp底物合用,因为底物浓度的极小改变可能会导致严重的治疗失败。
如果合用无法避免,则根据批准的产品说明书增加P-gp底物的剂量。[1]
贮藏
30℃以下保存。[1]
有效期
36个月。[1]
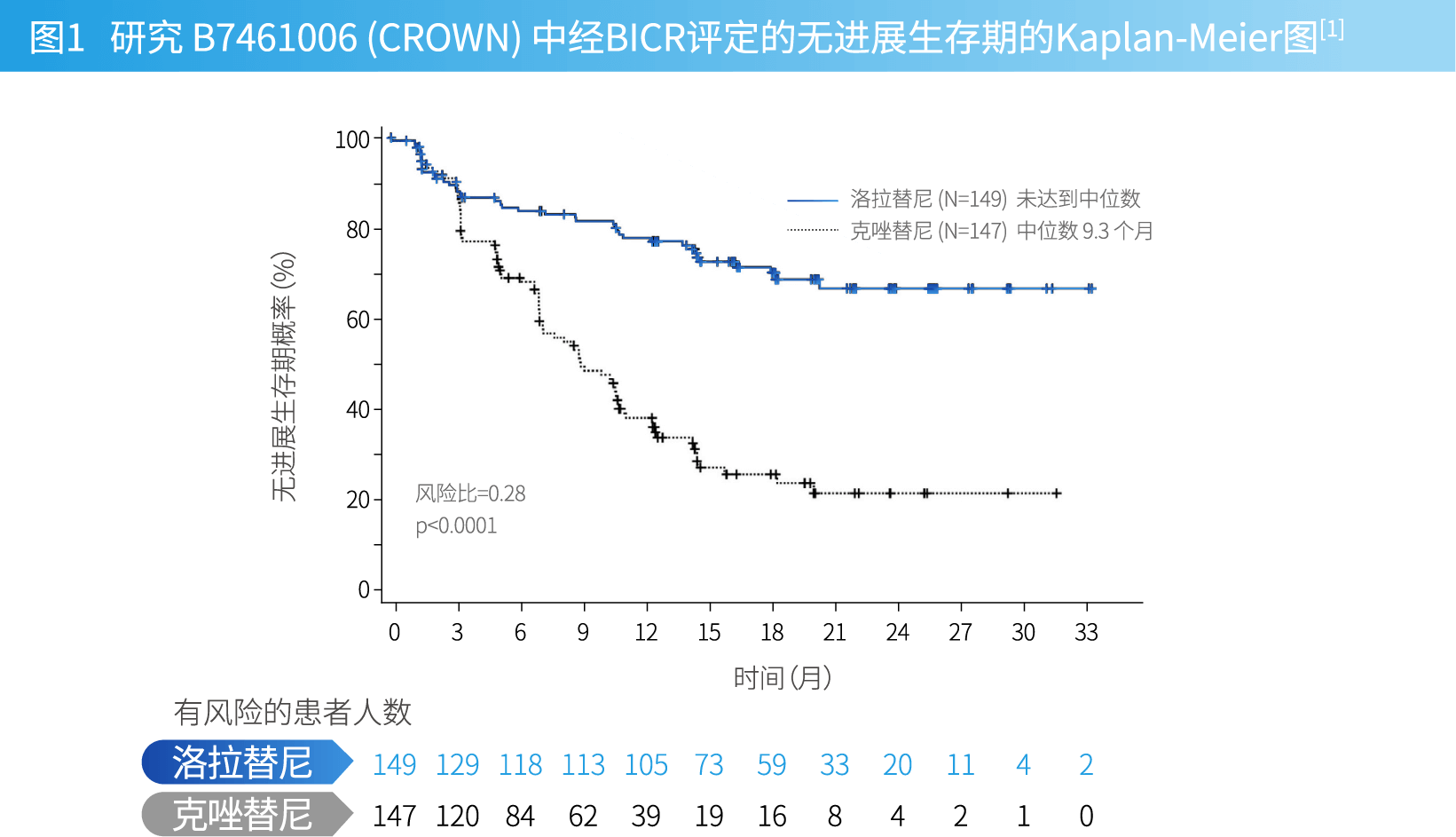
既往未接受过治疗的ALK阳性转移性NSCLC(CROWN研究)[1]
- 在一项开放、随机、阳性对照、多中心研究(研究B7461006;NCT03052608)中,确定了本品用于治疗既往未接受过针对转移性疾病的系统性治疗的ALK阳性NSCLC患者的疗效。要求患者的ECOG体力状态为0至2,并且经VENTANA ALK(D5F3)CDx检测确定为ALK阳性NSCLC。同时纳入了存在接受过或未接受过治疗的无症状中枢神经系统 (CNS) 转移(包括软脑膜转移)、达到神经系统稳定的患者。要求患者在随机分组前至少2周(对于立体定向放射或部分放射)或4周(对于全脑放射)完成放射治疗。将患有严重的急性或慢性精神病(包括近期[过去一年内]或目前有自杀想法或行为)的患者排除在外。
- 患者按1:1的比例随机分组,以本品100mg每日一次口服给药或克唑替尼250mg每天两次口服给药。按人种(亚洲人与非亚洲人)和基线时是否存在CNS转移进行随机化分层。两组的治疗均持续到出现疾病进展或不可接受的毒性。主要的疗效结果指标是由盲态独立中心审查(BICR)根据实体瘤疗效评价标准 (RECIST)1.1版(v1.1)确定的无进展生存期(PFS)。其他的疗效结果指标包括总生存期(OS)和由BICR确定的肿瘤评估相关数据,包括总体缓解率(ORR)和缓解持续时间(DOR)。在基线时存在可测量的CNS转移的患者中,结果指标还包括由BICR确定的颅内总体缓解率(IC-ORR)和颅内缓解持续时间(IC-DOR)。 [1]
表1和图1汇总了研究B7461006中经BICR评定的疗效结果。结果表明,洛拉替尼组的PFS较克唑替尼组有显著改善。在数据截止点时,OS数据尚不成熟。 [1]
表1 研究 B7461006 (CROWN) 的疗效结果 疗效指标 本品
N=149克唑替尼
N=147无进展生存期 事件数,n (%) 41 (28%) 86 (59%) 疾病进展,n (%) 32 (22%) 82 (56%) 死亡,n (%) 9 (6%) 4 (3%) 中位数(月数)(95% CI)a NE(NE,NE) 9.3 (7.6, 11.1) 风险比(95% CI)b 0.28(0.19,0.41) P值* <0.0001 总体缓解率 总体缓解率(95% CI)c 76% (68, 83) 58% (49, 66) 完全缓解 3% 0% 部分缓解 73% 58% 缓解持续时间 缓解人数,n 113 85 中位数,月(范围) NE (0.9, 31.3) 11 (1.1, 27.5) 缓解持续时间≥6个月,n (%) 101 (89%) 53 (62%) 缓解持续时间≥12个月,n (%) 79 (70%) 23 (27% ) 缓解持续时间≥18个月,n (%) 34 (30%) 9 (11%) 缩略词:
CI=置信区间;N=患者例数;NE=不可估计;PFS=无进展生存期。
* p 值基于单侧分层对数秩检验。
a 基于 Brookmeyer 和 Crowley 方法。
b 风险比基于 Cox 比例风险模型。
c 使用基于二项分布的精确方法。
曾接受过ALK激酶抑制剂治疗的ALK阳性转移性NSCLC
在一项非随机、剂量范围与活性评估、多队列、多中心的研究(研究B7461001;NCT01970865)中,在曾接受一种或多种ALK激酶抑制剂治疗的ALK阳性转移性NSCLC患者亚组中证实了本品的疗效。按照要求,该研究中包括的患者根据RECISTv1.1确定具有至少1处可测量靶病灶的转移性疾病,ECOG体力状态为0至2,并且有根据荧光原位杂交(FISH)试验或通过免疫组织化学(IHC)检测确定的肿瘤组织ALK重排记录,接受本品100mg每日一次口服给药。同时纳入了存在无症状CNS转移的患者(包括进入研究前的2周内使用稳定或降低剂量的激素的患者)。将患有严重、急性或慢性精神病(包括有自杀想法或行为)的患者排除在外。此外,对于ALK阳性转移性NSCLC患者,规定了每个单独队列先前治疗的程度和类型。主要疗效指标为ORR和颅内ORR,由独立中心审查(ICR)委员会根据RECISTv1.1进行评估。[1]
| 研究B7461001的疗效结果[1] | ||
|---|---|---|
| 疗效指标 | 总体 N=215 | |
| 总体缓解率a(95% CI)b | 48%(42, 55) | |
| 完全缓解 部分缓解 | 4% 44% | |
| 缓解持续时间 | ||
| 中位数(月数) c(95% CI) | 12.5(8.4, 23.7) | |
| 研究B7461001中有可测量颅内病变患者的颅内缓解率[1] | ||
|---|---|---|
| 疗效指标 | 颅内 N=89 | |
| 颅内缓解率a(95% CI)b | 60% (49, 70) | |
| 完全缓解 部分缓解 | 21% 38% | |
| 缓解持续时间 | ||
| 中位数(月数) c(95% CI) | 19.5(12.4,NR) | |
缩略词:
CI=置信区间;N=患者人数;NR=未达到。
a 依据独立中心评估结果。
b 采用基于二项分布的精确方法。
c 采用 Kaplan-Meier 方法进行估算。
在对规定了先前治疗方式的亚组的探究性分析中,本品的缓解率为: [1]
曾接受克唑替尼和至少一种其他ALK抑制剂且伴或不伴化疗的119名患者,
ORR=39%(95% CI: 30, 48),
曾接受阿来替尼作为唯一一种ALK抑制剂且伴或不伴化疗的13名患者,
ORR=31%(95% CI: 9, 61),
曾接受塞瑞替尼作为唯一一种ALK抑制剂且伴或不伴化疗的13名患者,
ORR=46%(95% CI: 19, 75)。
- 说明书中提供了在研究B7461001(N=327)和研究B7461006 (N=149)中接受本品100mg每日一次给药的476名患者的数据。[1]
- 在476名接受本品的患者中75%的患者暴露时间为6个月或更长,61%的患者暴露时间超过1年。在该合并安全性人群中,476名接受本品的患者中最常见的不良反应(≥20%)和最常见的3-4级实验室检查值异常(≥20%)见下图。 [1]

既往未接受过治疗的ALK阳性转移性NSCLC(CROWN研究)[1]
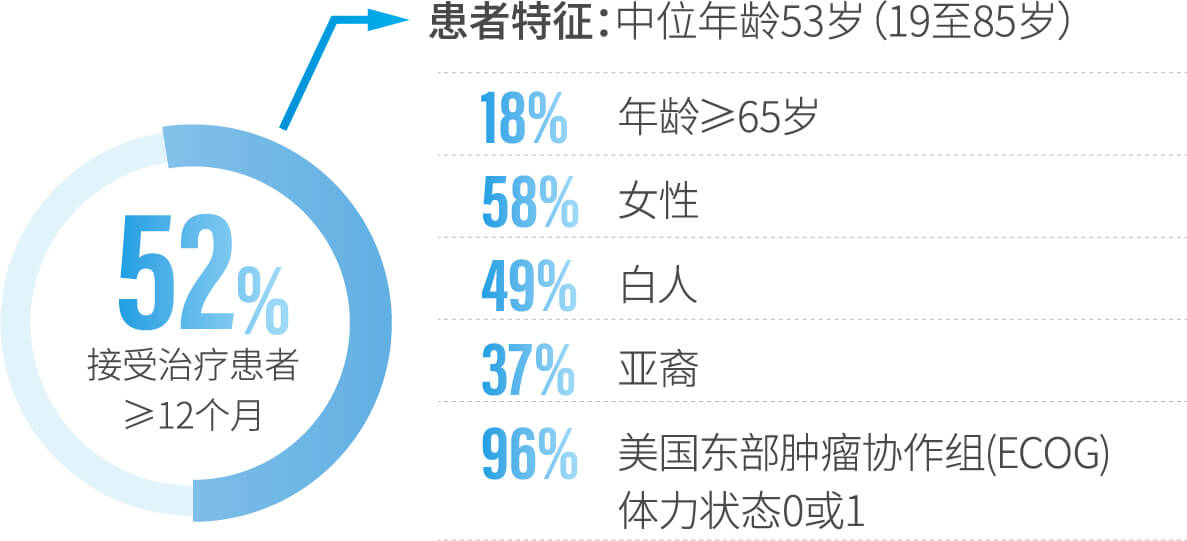
- 在一项治疗既往未针对晚期疾病进行系统性治疗的ALK阳性、局部晚期或转移性NSCLC患者的随机、开放、阳性对照试验中,在149名ALK阳性NSCLC患者中评估了本品的安全性。本品的中位暴露持续时间为16.7个月(4天至34.3个月),76%的患者接受了至少12个月的本品治疗。该研究中接受本品治疗的患者发生的不良反应见下图。

既往接受过治疗的ALK阳性转移性NSCLC[1]
下述数据反映了研究B7461001(一项多队列、非比较性试验)中295名接受本品100mg每日一次口服治疗的ALK阳性或ROS1阳性转移性NSCLC患者的暴露情况。本品的中位暴露持续时间为12.5个月(1天至35个月),52%的患者接受了本品≥12个月的治疗。
最常见(≥20%)的不良反应为水肿、周围神经病、认知影响、呼吸困难、疲乏、体重增加、关节疼痛、情绪影响和腹泻;在≥20%的患者中出现的实验室检查值异常中,最常见的为高胆固醇血症、高甘油三酯血症、贫血、高血糖、AST升高、低白蛋白血症、ALT升高、脂肪酶升高和碱性磷酸酶升高。

不良反应分级表[3]
- 分级是把不良事件(AE)的严重程度进行归类。CTCAE在基于下述基础原则的基础上运用独特的临床描述将不良事件(AE)的严重程度分为1~5级:

* 工具性日常生活活动是指做饭、购买杂货或衣服、使用电话、理财等。
** 自理性日常生活活动是指洗澡、穿衣和脱衣、进食、如厕、服用药物,而不是卧床不起。
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
AE分级信息[3]
| 高胆固醇血症 | |
|---|---|
| 1级 | >正常值上限-300mg/dL;>正常值上限-7.75mmol/L |
| 2级 | >300-400mg/dL;>7.75-10.34mmol/L |
| 3级 | >400-500mg/dL;>10.34-12.92mmol/L |
| 4级 | >500 mg/dL;>12.92mmol/L |
| 5级 | - |
| 高甘油三酯血症 | |
|---|---|
| 1级 | 150-300mg/dL;1.71-3.42mmol/L |
| 2级 | >300-500mg/dL;>3.42-5.7mmol/L |
| 3级 | >500-1000mg/dL;>5.7-11.4mmol/L |
| 4级 | >1000mg/dL;>11. 4mmol/L |
| 5级 | 死亡 |
注:不良反应严重程度依据美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
概况
- 在接受本品给药的患者中可能出现血清胆固醇和甘油三酯升高的情况。[1]
- 在476名接受本品100mg每日一次给药的患者中,有18%发生了3或4级总胆固醇升高,有19%发生了3或4级甘油三酯升高。高胆固醇血症和高甘油三酯血症的中位发生时间为15天。在研究B7461001和研究B7461006中的胆固醇和甘油三酯升高的患者中,约4%和7%的患者需要暂时停用本品,1%和3%的患者需要降低剂量。有83%的患者需要开始服用降脂药物,开始服用这类药物的中位时间为17天。[1]
处理策略
- 在高脂血症患者中开始使用或增加降脂剂的剂量。在开始服用本品之前,以及在开始服用本品之后第1和第2个月时监测血清胆固醇和甘油三酯,并在此后定期监测。对第一次出现的情况,暂停并以相同剂量恢复给药;根据严重程度,对复发的情况,以相同剂量或降低一个剂量水平继续给药。[1]
- 若合并年龄(男性≥55岁;女性≥65岁)和/或达到动脉粥样硬化性心血管疾病(ASCVD)风险高危或极高危者,使用他汀类或他汀联合降脂药物治疗后,监测频率需增加至每1-3个月一次。[6]
- 高血脂和肿瘤治疗有各自独立的目标、疗程以及调整方法,他汀类降脂药物选择的核心原则为避免药物相互作用。首选瑞舒伐他汀、匹伐他汀或普伐他汀;若需要在他汀类基础上增加治疗强度,可联合使用依折麦布或非诺贝特,次之可选择鱼油和烟酸;若他汀类联合非诺贝特治疗无效,可考虑依折麦布。[6]
| 4级高胆固醇血症或4级高甘油三酯血症 | 暂停服用本品,直到高胆固醇血症和/或高甘油三酯血症恢复至2级或以下。以相同剂量继续服用本品。 如果重度高胆固醇血症和/或高甘油三酯血症复发,则降低一个剂量水平继续服用本品。 |
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
AE分级信息[3]
| 认知障碍 | |
|---|---|
| 1级 | 轻度认知功能障碍;不影响工作/生活/学习;不需要特殊教育服务/装置 |
| 2级 | 中度认知功能障碍;影响工作/生活/学习,但是能独立生活;需要兼职专业护理 |
| 3级 | 严重认知障碍;明显影响工作/生活/学习 |
| 4级 | - |
| 5级 | - |
| 癫痫发作 | |
|---|---|
| 1级 | 短暂的局灶性发作,不影响意识 |
| 2级 | 短暂的全身性发作 |
| 3级 | 经医学干预后,仍出现多发性发作 |
| 4级 | 危及生命;延长反复发作时间 |
| 5级 | 死亡 |
| 幻觉 | |
|---|---|
| 1级 | 轻度症状 |
| 2级 | 中度症状 |
| 3级 | 重度症状;不需住院 |
| 4级 | 危及生命;危害自己或他人,需住院 |
| 5级 | 死亡 |
注:不良反应严重程度依据美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
概况
- 服用本品的患者可能会发生广泛的中枢神经系统(CNS)影响。这些影响包括癫痫发作、精神影响和认知功能、情绪(包括自杀想法)、言语、精神状态和睡眠改变。[1]
- 总体而言,在临床研究中接受本品100mg每日一次的476名患者中,有52%发生了中枢神经系统影响。有28%发生了认知影响;这些事件中有2.9%为重度影响(3或4级)。有21%的患者出现了情绪影响;这些事件中有1.7%为重度影响。有11%的患者出现了言语影响;这些事件中有0.6%为重度影响。有7%的患者出现了精神影响;这些事件中有0.6%为重度影响。有1.3%的患者出现了精神状态改变;这些事件中有1.1%为重度影响。有1.9%的患者出现癫痫发作,有时与其他神经系统疾病相关。有12%的患者出现睡眠影响。任何CNS影响首次出现的中位时间为1.4个月(1天至3.4年)。总体而言,2.1%的患者因CNS影响需要永久停用本品;10%的患者需要暂时停用,8%的患者需要降低剂量。[1]
处理策略
- 根据严重程度暂停用药并以相同剂量或降低一个剂量水平恢复给药,或者永久停用本品。[1]
- 启动治疗前与患者、家属以及照护者沟通,告知若患者出现思考障碍、情绪变化、幻觉、癫痫、言语或睡眠变化等时需立即报告。定期通过影像学监测CNS状态(开始治疗后每6周一次直至30个月,之后每3个月一次)。若患者有精神病史,需评估其既往治疗方案以及最末次用药与开始洛拉替尼的时间间隔。[6]
- 大多数CNS AE能够在调整剂量或不进行临床干预的情况下缓解。剂量调整是CNS AE的有效管理方式,且不影响疗效。若CNS反应影响患者日常生活,则有必要进行治疗干预,需根据药物相互作用来选择对洛拉替尼影响最小的精神科药物。对于情绪改变,焦虑可选择苯二氮卓类、抗抑郁药、静修与心理治疗,抑郁可使用抗抑郁药;对于精神影响,可选择药物(首选奥氮平)或干预治疗。[6]
| 1级 | 按相同剂量水平继续用药或暂停用药直到恢复至基线。以相同剂量或降低一个剂量水平继续服用本品。 |
| 2级或3级 | 暂停服用本品,直到恢复至0或1级。降低一个剂量水平继续服用本品。 |
| 4级 | 永久停用本品。 |
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
AE分级信息[3]
| 高血糖症 | |
|---|---|
| 1级 | 空腹葡萄糖浓度>正常值上限-160mg/dL; 空腹葡萄糖浓度>正常值上限-8.9mmol/L |
| 2级 | 空腹葡萄糖浓度>160-250mg/dL;>8.9-13.9mmol/L |
| 3级 | 空腹葡萄糖浓度>250-500mg/dL; >13.9-27.8mmol/L;需要住院治疗 |
| 4级 | >500mg/dL;>27.8mmol/L;危及生命 |
| 5级 | 死亡 |
注:不良反应严重程度依据美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
概况
- 接受本品治疗的患者可能出现高血糖。[1]
- 在接受本品100mg每日一次治疗的患者中,有9%出现了高血糖,其中3.2%的患者出现了3或4级事件。至高血糖发作的中位时间为4.8个月(1天至2.9年),0.8%的患者因高血糖而暂停服用本品。[1]
处理策略
- 在开始本品治疗之前评估空腹血糖并在此后定期评估。根据高血糖的严重程度暂停用药并降低一个剂量水平恢复给药,或者永久停用本品。[1]
| 3级(尽管进行了最佳的降糖治疗,但仍大于250mg/dL)或4级 | 暂停服用本品直到高血糖得到充分控制,然后降低一个剂量水平继续服用本品。 如果不能通过最佳的医疗措施有效控制高血糖,则永久停用本品。 |
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
AE分级信息[3]
| 完全性房室传导阻滞 | |
|---|---|
| 1级 | - |
| 2级 | 非紧急的医疗处理 |
| 3级 | 有症状,药物不能控制,需要仪器(例如:起搏器)控制 |
| 4级 | 危及生命;需要紧急治疗 |
| 5级 | 死亡 |
| I度房室传导阻滞 | |
|---|---|
| 1级 | 无症状,不需治疗 |
| 2级 | 非紧急的医疗处理 |
| 3级 | - |
| 4级 | - |
| 5级 | - |
注:不良反应严重程度依据美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
概况
- 在接受本品给药的患者中可能会发生PR间期延长和房室(AV)传导阻滞。在接受本品100mg每日一次给药并且具有基线心电图(ECG)的476名患者中,有1.9%出现房室传导阻滞,且0.2%发生了3级房室传导阻滞并接受了起搏器植入。[1]
处理策略
- 在开始服用本品之前监测ECG,并在此后定期监测。对于接受起搏器植入的患者,应暂停用药并以降低一个剂量水平或相同的剂量恢复给药。对于没有起搏器的患者,如果复发,应永久停用本品。[1]
| 二度房室传导阻滞 | 暂停服用本品,直到PR间期小于200ms。降低一个剂量水平继续服用本品。 |
| 首次出现完全性房室传导阻滞 | 暂停服用本品,直到植入起搏器或PR间期<200ms。 如果植入了起搏器,则以相同剂量继续服用本品。 如果没有植入起搏器,则降低一个剂量水平继续服用本品。 |
| 再次出现完全性房室传导阻滞 | 植入起搏器或永久停用本品 |
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
AE分级信息[3]
| 高血压 | |
|---|---|
| 1级 | 高血压前期 (收缩压120-139mmHg和(或)舒张压80-89mmHg) |
| 2级 | 第一阶段高血压(收缩压140-159mmHg和(或)舒张压90-99mmHg);需要医学干预;反复或持续性高血压(≥24小时);有症状的,舒张压升高>20mmHg或既往血压正常、血压升高至>140/90mmHg;需要单药治疗 |
| 3级 | 第二阶段高血压(收缩压≥160mmHg和(或)舒张压≥100mmHg);需要医学干预;需要一种以上的药物治疗,或者在既往降压治疗基础上强化治疗 |
| 4级 | 出现严重危及生命的结果(如恶性高血压,一过性或持续性神经功能不全,高血压危象);需要急诊手术 |
| 5级 | 死亡 |
注:不良反应严重程度依据美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
概况
- 接受本品治疗的患者可能出现高血压。[1]
- 在接受本品100mg每日一次治疗的患者中,有13%出现了高血压,其中6%的患者出现了3或4级事件。至高血压发作的中位时间为6.4个月(1天至2.8年),2.3%的患者因高血压而暂停服用本品。[1]
处理策略
- 应在开始本品治疗之前控制血压,服药2周后监测血压,之后在本品治疗期间至少每月监测一次。根据高血压的严重程度暂停用药并降低一个剂量水平恢复给药,或者永久停用本品。[1]
| 3级 收缩压≥160mmHg或舒张压≥100mmHg;需要进行医疗干预;需要使用一种以上的降压药物,或需要进行比以前更加强化的治疗 | 暂停服用本品直到高血压恢复至1级或以下(收缩压<140mmHg和舒张压<90mmHg),然后以相同剂量继续服用本品。 如果3级高血压复发,则暂停服用本品直到高血压恢复至1级或以下,并降低一个剂量水平继续服用本品。 如果不能通过最佳的医疗措施有效控制高血压,则永久停用本品。 |
| 4级 危及生命,需要紧急干预 | 暂停服用本品直到高血压恢复至1级或以下,并降低一个剂量水平继续服用本品或永久停用本品。 如果4级高血压复发,则永久停用本品。 |
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
AE分级信息[5]
| 间质性肺疾病 | |
|---|---|
| 1级 | 无症状,仅临床检查发现;活动能力正常;影像学改变<25%;无需干预 |
| 2级 | 有症状;工具性日常生活活动*受限;影像学改变25%-50%;需要药物治疗 |
| 3级 | 症状严重;个人日常生活自理活动**受限;影像学改变51%-75%;需氧疗 |
| 4级 | 危及生命的呼吸功能衰竭;卧床;影像学改变>75%;紧急抢救(如气管插管或气管切开) |
| 5级 | 死亡 |
* 工具性日常生活活动指做饭、购买杂物或衣服、使用电话、理财等。 | |
注:不良反应严重程度依据美国国立癌症研究所的不良事件通用术语评估标准第5.0版(NCI-CTCAE v5.0)
概况
- 本品给药可能会引起重度或危及生命的肺部不良反应,即间质性肺病(ILD)/非感染性肺炎。在接受本品100mg每日一次给药的患者中,有1.9%发生了ILD/非感染性肺炎,其中0.6%的患者发生了3或4级ILD/非感染性肺炎。4名患者(0.8%)因ILD/非感染性肺炎而停止服用本品。[1]
处理策略
- 对任何呼吸系统症状恶化且可能预示ILD/非感染性肺炎(例如呼吸困难、咳嗽和发热)的患者,立即诊断是否为ILD/非感染性肺炎。如果怀疑患有ILD/非感染性肺炎,应立即停用本品。对于与本品治疗相关的任何程度的ILD/非感染性肺炎,应永久停用本品。[1]
- 对于≥2级ILD或非感染性肺炎,应给予皮质类固醇并考虑经验性抗生素或支气管肺泡灌洗;3级-4级应住院治疗,在上述措施基础上进行支气管镜检和/或活检、使用免疫抑制剂、给予吸氧和重症监护等。[6]
| 任何级别的与治疗相关的ILD/非感染性肺炎 | 永久停用本品。 |
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
概况
合用强效CYP3A诱导剂的严重肝脏毒性风险:
- 接受本品单次给药和利福平(一种强效CYP3A诱导剂)多次每日给药的12名健康受试者中有10名出现了严重肝脏毒性。50%的受试者出现4级丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)升高,33%的受试者出现3级ALT或AST升高,8%的受试者出现2级ALT或AST升高。ALT或AST升高发生在3天内并在中位时间15天后(7至34天)恢复到正常范围内;3或4级ALT或AST升高的受试者中位恢复时间为18天,2级ALT或AST升高的受试者中位恢复时间为7天。[1]
处理策略
- 对于轻度肝损害的患者,不建议进行剂量调整(总胆红素≤正常值上限[ULN]伴AST>ULN,或者总胆红素>1至1.5×ULN伴任何AST)。尚未确定本品对于中度(总胆红素≥1.5至3.0×ULN伴任何AST)或重度(总胆红素>3.0×ULN伴任何AST)肝损害患者的推荐剂量。[1]
- 对于3级-4级肝毒性,暂停治疗通常能够逆转。应参照针对非特异性药物不良反应的剂量调整方案,暂停洛拉替尼直至症状缓解至≤2级或基线值,之后减量继续治疗。[6]
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
AE分级信息[3]
| 局限性水肿 | |
|---|---|
| 1级 | 局限性于特定区域,不会致残或功能损伤 |
| 2级 | 中等的局限性水肿,需要治疗;影响工具性日常生活活动 |
| 3级 | 重度局限性水肿,需要治疗;影响个人日常生活活动 |
| 4级 | - |
| 5级 | - |
注:不良反应严重程度依据美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
处理策略
- I/II期B7461001研究(NCT01970865)正在考察洛拉替尼在初治或ALK抑制剂经治(接受过/未接受化疗)的晚期ALK阳性或ROS原癌基因1(ROS1)阳性NSCLC患者中的安全性和疗效。在这项I/II期安全性分析中,作者列举了以下水肿管理方法:在开始剂量调整前,轻度水肿患者应考虑使用压力袜、抬高腿部和改变生活方式,如增加运动和限制膳食盐摄入。利尿剂(通常为呋塞米)与这些保守措施联合使用已被证明有效。对于呋塞米单药治疗无效的水肿,加用螺内酯可能有益。对于持续存在或恶化的水肿,可参考一般情况下洛拉替尼剂量调整指南。[4]
- 当出现水肿时,首先应排除其他潜在诱因,如心源性、其他药物、低蛋白血症、甲状腺功能减退、肢体血管栓塞等。建议轻中度患者采取保守的物理措施,如使用压缩绷带或长袜、抬高下肢,以及改善生活方式如限盐、加强体育锻炼等。重度水肿情况下,尤其显著影响生活质量或表现为肺水肿时,可短期使用最小有效剂量的呋塞米。必要时洛拉替尼减量或暂时停药,密切观察。[6]
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
概况
- 基于动物研究的发现及本品的作用机制,妊娠女性服用本品可能会对胎儿造成伤害。[1]
- 在器官形成期间向妊娠大鼠和兔灌胃给药,母体暴露量等于或低于推荐剂量每日一次100mg下的人体暴露量(基于曲线下面积(AUC))的洛拉替尼时,导致畸形、胎盘植入后丢失率增加和流产。[1]
处理策略
应告知妊娠女性本品对胎儿的潜在风险。建议有生育能力的女性使用有效的非激素避孕法,因为本品在治疗期间和末次剂量后至少6个月可使激素避孕药失效。对于女性伴侣具有生育能力的男性患者,建议在接受本品治疗期间及末次给药后3个月内使用有效的避孕措施。[1]
声明
- 关于洛拉替尼更多详细信息请参见完整版药品说明书。
- 辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
1. Therapy for Stage IV Non-Small-Cell Lung Cancer With Driver Alterations: ASCO Living Guideline
2. Management of Stage III Non-Small-Cell Lung Cancer: ASCO Guideline
3. NCCN Guidelines: Non-Small Cell Lung Cancer
4. ESMO Clinical Practice Guidelines: Lung and Chest Tumours
6. ASCO Guideline: Management of Stage III Non–Small-Cell Lung Cancer
7. Palliative Thoracic Radiation Therapy for Non-Small Cell Lung Cancer (ASTRO)
8. Stereotactic Body Radiation Therapy (SBRT) for Early-Stage Non-Small Cell Lung Cancer (ASTRO)
9. Definitive and Adjuvant Radiation Therapy in Locally Advanced Non-Small Cell Lung Cancer (ASTRO)
辉瑞医学信息网站指南版块查阅下载 下载链接
如需指南共识原文,请您联系辉瑞医学信息部:[email protected], 或通过辉瑞医学信息网站在线提问获取。
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
CROWN研究(B7461006研究,注册编号NCT03052608)
- 2024 《Journal of Clinical Oncology》杂志
Lorlatinib Versus Crizotinib in Patients With Advanced ALK-Positive Non–Small Cell Lung Cancer: 5-Year Outcomes From the Phase III CROWN Study - 2024 ASCO会议
Lorlatinib vs crizotinib in treatment-naïve patients with advanced ALK+ non-small cell lung cancer: 5-year progression-free survival and safety from the CROWN study - 2023 ESMO会议
Updated patient-reported outcomes from the CROWN study: Analyses in first-line ALK+ patients with (w) and without (w/o) baseline brain metastases (BMs) and w or w/o central nervous system adverse events (CNS AEs) - 2023 ESMO会议
First-line (1L) Lorlatinib in Patients with ALK-Positive aNSCLC: Updated Network Meta-Analysis (NMA) and Review of Ten NMAs - 2023 ESMO会议
First-line (1L) Lorlatinib in Patients with ALK-Positive aNSCLC: Updated Network Meta-Analysis (NMA) and Review of Ten NMAs - 2023 WCLC会议
AI-powered intracranial tumor response predicts systemic progression with high concordance in endpoint evaluation in the phase III CROWN study - 2023 Future Oncology》杂志
Plain language summary of the updated results from the CROWN study comparing lorlatinib with crizotinib in people with advanced non-small-cell lung cancer - 2023 《Journal of Thoracic Oncology》杂志
Early Circulating Tumor DNA Dynamics and Efficacy of Lorlatinib in Patients With Treatment-Naive, Advanced, ALK-Positive NSCLC - 2023 《JTO Clinical and Research Reports》杂志
Asian Subgroup Analysis of the Randomized Phase 3 CROWN Study of First-Line Lorlatinib Versus Crizotinib in Advanced ALK-Positive NSCLC - 2023 ASCO会议
Management of patients with ALK-positive advanced non-small cell lung cancer who received brain radiotherapy on study in the phase 3 CROWN trial - 2023 《Journal of Clinical Oncology》杂志
Post Hoc Analysis of Lorlatinib Intracranial Efficacy and Safety in Patients With ALK-Positive Advanced Non-Small-Cell Lung Cancer From the Phase III CROWN Study - 2022 《Lancet Respiratory Medicine》杂志
Efficacy and safety of first-line lorlatinib versus crizotinib in patients with advanced, ALK-positive non-small-cell lung cancer: updated analysis of data from the phase 3, randomised, open-label CROWN study - 2022 《Lung Cancer》杂志
Patient-reported outcomes from the randomized phase 3 CROWN study of first-line lorlatinib versus crizotinib in advanced ALK-positive non-small cell lung cancer - 2022 ESMO会议
Updated analyses from the CROWN study of first-line lorlatinib vs crizotinib in Asian patients with ALK-positive non-small cell lung cancer (NSCLC) - 2022 ESMO会议
Health-related quality of life (HRQOL) in patients with ALK+ non-small cell lung cancer (NSCLC) in the phase III CROWN study - 2022 ESMO会议
Resistance mechanisms to lorlatinib or crizotinib in treatment-naive patients (pts) with ALK+ advanced non-small cell lung cancer (NSCLC) - 2022 ESMO会议
Long-term intracranial safety and efficacy analyses from the phase III CROWN study - 2022 ASCO会议
Progression-free survival with subsequent anticancer therapies from a phase 3 trial of lorlatinib in treatment-naive patients (pts) with ALK+ advanced non–small cell lung cancer (NSCLC). - 2022 ASCO会议
Phase 3 trial of lorlatinib in treatment-naive patients (Pts) with ALK-positive advanced non–small cell lung cancer (NSCLC): Comprehensive plasma and tumor genomic analyses - 2022 AACR会议
Updated efficacy and safety from the phase 3 CROWN study of first-line lorlatinib vs crizotinib in advanced anaplastic lymphoma kinase (ALK)-positive non-small cell lung cancer (NSCLC) - 2021 《Future Oncology》杂志
Plain language summary of the CROWN study comparing lorlatinib with crizotinib for people with untreated non-small cell lung cancer - 2021 WCLC会议
Lorlatinib in First Line Treatment of Patients With ALK-Positive NSCLC: A Network Meta-Analysis - 2021 ESMO会议
First-line lorlatinib versus crizotinib in ALK-positive non-small cell lung cancer: Asian subgroup analysis of CROWN - 2021 ESMO会议
Dose Modification for the Management of CNS Adverse Events in the Phase III CROWN Study of Lorlatinib in Non-Small Cell Lung Cancer (NSCLC) - 2021 ASCO会议
Early circulating tumor (ct) DNA dynamics and efficacy of lorlatinib: Analysis from the CROWN study - 2021 AACR会议
Efficacy of Lorlatinib in Treatment-Naïve Patients (pts) With ALK-Positive Advanced Non-Small Cell Lung Cancer (NSCLC) in Relation to EML4-ALK Variant Type and ALK Mutations - 2021 WCLC会议
Patient-Reported Outcomes from the Randomized Phase 3 CROWN Study of First-Line Lorlatinib versus Crizotinib in ALK+ NSCLC - 2020 《New England Journal of Medicine》杂志
First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer - 2020 ESMO会议
Lorlatinib vs Crizotinib in the First-Line Treatment of Patients (pts) with Advanced ALK-Positive Non-Small Cell Lung Cancer (NSCLC): Results of the Phase III CROWN Study
B7461024研究(注册编号:NCT03909971)
如需指南共识原文,请您联系辉瑞医学信息部:[email protected], 或通过辉瑞医学信息网站在线提问获取。
国内
- 2023中华肿瘤大会(CSO)
2023年03月15-17日 石家庄
国外
- 欧洲肺癌大会(ELCC 2024)
2024年3月20-23日 捷克布拉格 - 美国临床肿瘤学会(ASCO)2024年会
2024年5月31日-6月4日 美国芝加哥 - 2024世界肺癌大会(WCLC)
2024年9月7-10日 美国圣迭戈 - 欧洲肿瘤内科学会(ESMO)2024年会
2024年9月13-17日 西班牙巴塞罗那 - 2024世界癌症大会(WCC)
2024年9月17-19日 瑞士日内瓦
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
[1] 洛拉替尼片说明书
[2] Johnson TW, et al. Discovery of (10R)-7-amino-12-fluoro-2,10,16-trimethyl-15-oxo-10,15,16,17-tetrahydro-2H-8, 4-(metheno)pyrazolo[4,3-h][2,5,11]-benzoxadiazacyclotetradecine-3-carbonitrile (PF-06463922), a macrocyclic inhibitor of anaplastic lymphoma kinase (ALK) and c-ros oncogene 1 (ROS1) with preclinical brain exposure and broad-spectrum potency against ALK-resistant mutations. J Med Chem. 2014 Jun 12;57(11):4720-44.
[3] 美国国立癌症研究所的不良事件通用术语评估标准第4.03版(NCI-CTCAE v4.03)
[4] Shaw AT, Felip E, Bauer TM, et al. Lorlatinib in non-small- cell lung cancer with ALK or ROS1 rearrangement: an international, multicentre, open-label, single-arm first-in- man Phase 1 trial. Lancet Oncol. 2017;18(12):1590-9.
[5] 美国国立癌症研究所的不良事件通用术语评估标准第5.0版(NCI-CTCAE v5.0)
[6] 中国胸部肿瘤研究协作组.洛拉替尼特殊不良反应管理中国专家共识.2022;25(8):555-566.



