本品联合恩扎卢胺用于HRR基因突变的转移性去势抵抗性前列腺癌 (mCRPC) 成人患者。1
化学结构式1

分子式1
C26H22F2N6O4S
作用机制1
他拉唑帕利是一种聚腺苷二磷酸核糖聚合酶(PARP,包括PARP1和PARP2)抑制剂,该酶在DNA修复中发挥作用。携带DNA修复基因(包括BRCA1和BRCA2)缺陷的癌细胞系的体外试验显示,他拉唑帕利诱导的细胞毒性可能涉及抑制PARP酶活性和增加PARP-DNA复合物的形成,从而导致DNA损伤、细胞增殖减少和细胞凋亡。他拉唑帕利在携带突变BRCA1和BRCA2或野生型BRCA1和BRCA2的患者来源的乳腺癌异种移植瘤模型中可见抗肿瘤活性。
患者每日一次口服1mg本品单药之后,他拉唑帕利稳态时的平均[变异系数百分比(CV%)]AUC和最大观测血浆浓度(Cmax)分别为208 (37%) ng.hr/mL和16.4 (32%) ng/mL。平均(CV%)稳态Ctrough 为3.53 (61%) ng/mL。1
患者联合恩扎卢胺每日一次口服本品0.5mg(前列腺癌患者推荐剂量)后,平均(CV%)稳态Ctrough范围为3.29至3.68 ng/mL(45%-48%)。1
他拉唑帕利的药代动力学(PK)在0.025mg至2mg范围内呈线性。他拉唑帕利每日一次口服1mg后的中位蓄积比范围介于2.3至5.2之间。单独用药时,他拉唑帕利血浆浓度在2至3周内达到稳态,与恩扎卢胺联合用药时在9 周内达到稳态。1
本品用于转移性去势抵抗性前列腺癌之前,必须采用经国家药监局批准或其他经验证的检测方法确认患者存在HRR 基因突变(ATM、ATR、BRCA1、BRCA2、CDK12、CHEK2、FANCA、MLH1、MRE11A、NBN、PALB2 或 RAD51C)。1
(1)用量1
- 推荐剂量
本品联合恩扎卢胺使用,推荐剂量为0.5mg,每日口服一次,直到出现疾病进展或出现不可耐受的毒性。 - 恩扎卢胺的推荐给药剂量请参阅恩扎卢胺药品说明书。
- 接受本品和恩扎卢胺治疗的患者还应同时接受促性腺激素释放激素 (GnRH) 类似物治疗或应已接受双侧睾丸切除术。
(2)用法1
- 本品在进餐或空腹时均可服用。
- 整粒吞服,请勿打开或溶解胶囊。
- 若患者出现呕吐或漏服一剂本品,应在下一次给药时继续服用推荐剂量。
为控制不良反应,根据严重程度和临床表现,可考虑减量或中断治疗。剂量减少建议见表 1和表2。如果需要减少剂量三次以上,应停止使用本品治疗。1
表1 针对不良反应的剂量调整1
| 剂量减少 | 剂量水平 |
|---|---|
| 建议的起始剂量 | 0.5mg 每日一次 |
| 第一次减少剂量 | 0.35mg 每日一次 |
| 第二次减少剂量 | 0.25mg 每日一次 |
| 第三次减少剂量 | 0.1mg 每日一次 |
与恩扎卢胺相关的不良反应的剂量调整,请参阅恩扎卢胺说明书。
每个月以及出现临床指征时应监测全血细胞计数(参见【注意事项】)。
表2 针对不良反应的剂量调整和管理1
| 不良反应 | 剂量水平 | 恢复本品给药 |
|---|---|---|
| 血红蛋白 < 8g/dL | ≥ 9g/dL | 恢复本品给药时需要降低剂量 |
| 血小板计数 <50,000/μL | ≥75,000/μL | |
| 中性粒细胞计数 <1,000/μL | ≥1500/μL | |
| 3 级或 4 级非血液学毒性 | ≤1 级 | 恢复本品给药需考虑降低剂量或者停药 |
肝损害
肝损害患者建议无需调整剂量。1
肾损害
对于中度 (CLcr 30 – 59mL/min) 和重度 (CLcr 15 – 29mL/min) 肾损害患者应降低本品推荐剂量。1
对于重度肾损害患者,应监测不良反应是否增加,并根据建议针对不良反应调整剂量。对于轻度肾损害 (CLcr 60 –89 mL/min) 患者,建议无需调整剂量。目前尚未在需要血液透析的患者中进行本品的研究。1
肾损害患者的推荐剂量
对于中度肾损害 (CLcr 30 - 59mL/min) 患者,本品联合恩扎卢胺使用,推荐剂量为0.35 mg,每日口服一次。1
对于重度肾损害 (CLcr 15 - 29mL/min) 患者,本品联合恩扎卢胺使用,推荐剂量为0.25 mg,每日口服一次。1
儿童及青少年
尚无儿童或青少年人群使用经验。1
老年人
老年患者无需调整剂量。1
尚未研究本品与恩扎卢胺联合用药时同时使用P-gp抑制剂对他拉唑帕利暴露量的影响。本品与强效P-gp抑制剂合用时会导致他拉唑帕利暴露量的增加(参见【临床药理】),应避免伴随使用强效P-gp抑制剂,包括但不限于胺碘酮、卡维地洛、克拉霉素、考比司他、达芦那韦、决奈达隆、红霉素、茚地那韦、伊曲康唑、酮康唑、拉帕替尼、洛匹那韦、普罗帕酮、奎尼丁、雷诺嗪、利托那韦、沙奎那韦、特拉匹韦、替拉那韦和维拉帕米。当必须与P-gp抑制剂同时使用时,应监测患者不良反应是否增加,并根据建议针对不良反应调整剂量(参见【用法用量】)。1
与利福平合用时,不需要调整他拉唑帕利的剂量(参见【临床药理】)。尚未开展其他P-gp诱导剂对他拉唑帕利暴露量影响的研究。其他P-gp诱导剂(包括但不限于卡马西平、苯妥英和圣约翰草)可能会降低他拉唑帕利的暴露量。1
本品与BCRP 抑制剂同时使用可能会增加他拉唑帕利的暴露量(参见【临床药理】),这可能会增加不良反应的风险。当本品与BCRP抑制剂同时使用时,应监测患者不良反应是否增加,并根据建议针对不良反应调整剂量(参见【用法用量】)。1
群体PK分析表明,与降酸剂(包括质子泵抑制剂、组胺受体2拮抗剂[H2RA]或其他降酸剂)合用时,他拉唑帕利的吸收未受到显著影响。1
贮藏
密封,不超过30°C保存。1
请将本品放在儿童不能接触的地方。1
有效期
48 个月。1
TALAPRO-2 (NCT03395197) 研究是一项评估他拉唑帕利与恩扎卢胺联合治疗的疗效的随机、双盲、安慰剂对照、多队列试验,399 例HRR 基因突变型 (HRRm) mCRPC 患者以 1:1 的比例随机接受恩扎卢胺 160mg 每日一次联合他拉唑帕利 0.5mg 或安慰剂每日一次给药,直至出现不可接受的毒性或疾病进展。所有患者均接受了 GnRH 类似物或既往接受过双侧睾丸切除术,且在既往雄激素剥夺治疗期间出现了进展。可入组既往接受过 CYP17 抑制剂或多西他赛治疗转移性去势敏感性前列腺癌的患者 (mCSPC) 。使用基于实体瘤组织或基于循环肿瘤 DNA (ctDNA) 的下一代测序技术前瞻性地测定 HRR 基因的突变状态。要求患者至少携带直接或间接涉及 HRR 通路的12个基因(ATM、ATR、BRCA1、BRCA2、CDK12、CHEK2、FANCA、MLH1、MRE11A、NBN、PALB2 或 RAD51C)中的至少1个突变基因。1
按既往接受 CYP17 抑制剂或多西他赛治疗(是/否)进行随机化分层。1
中位年龄为 70 岁(范围:41 - 90);100% 为男性;68% 为白人,21% 为亚洲人,2.8% 为黑人,0.8% 为其他,7% 为不详/未报告;12% 为西班牙裔/拉丁美洲裔;基线 ECOG 体力状态为 0 (62%) 或 1 (38%)。39% 的患者仅患有骨疾病;15% 患有内脏性疾病。在mCSPC患者中,29% 的患者曾接受过多西他赛治疗,9% 的患者既往接受过 CYP17 抑制剂治疗。最常见发生突变的 HRR 基因 (>5%)(包括共发生突变)为:BRCA2 (34%)、ATM (22%)、CDK12 (19%)、CHEK2 (18%) 和 BRCA1 (6%)。1
主要疗效结果指标为BICR根据RECIST 1.1版和前列腺癌临床试验工作组 (PCWG3)(骨)标准评估的影像学无进展生存期 (rPFS)。另一个疗效结果指标是 OS。
在预先设定的中期分析中,与安慰剂联合恩扎卢胺治疗相比,随机分配至接受他拉唑帕利联合恩扎卢胺治疗在统计学上显著改善患者 rPFS 。在既往接受或未接受过 CYP17 抑制剂或多西他赛治疗的患者中观察到一致的 rPFS 结果。在 rPFS 分析之时,OS 数据尚未成熟(观察到24%的死亡事件)。表3 和图1 提供了疗效结果。1
表3 TALAPRO-2 研究的疗效结果(HRR 基因突变型 mCRPC)1
| 他拉唑帕利+ 恩扎卢胺 (N=200) | 安慰剂 + 恩扎卢胺 (N=199) |
|---|---|---|
| BICR 评估的影像学无进展生存期(rPFS) | ||
| rPFS 事件数量, n (%) | 66 (33) | 104 (52) |
| 中位月数 (95% CI) | NE (21.9, NE) | 13.8 (11.0, 16.7) |
| 风险比 (95% CI)* | 0.45 (0.33, 0.61) | |
| p 值† | < 0.0001 | |
缩略词:BICR = 盲态独立中心审查;CI = 置信区间;CSPC = 去势敏感性前列腺癌;HRRm = 同源重组修复基因突变型;mCRPC = 转移性去势抵抗性前列腺癌;N = 患者人数;NE = 不可评估。
* 风险比和 CI 基于针对 CSPC 的既往治疗分层的 Cox PH 模型计算。
† p 值是基于针对 CSPC 的既往治疗分层的对数秩检验得出,并与边界值 0.0076 进行比较。
图1 TALAPRO-2研究中 rPFS 的 Kaplan-Meier 曲线(HRR 基因突变型 mCRPC)1
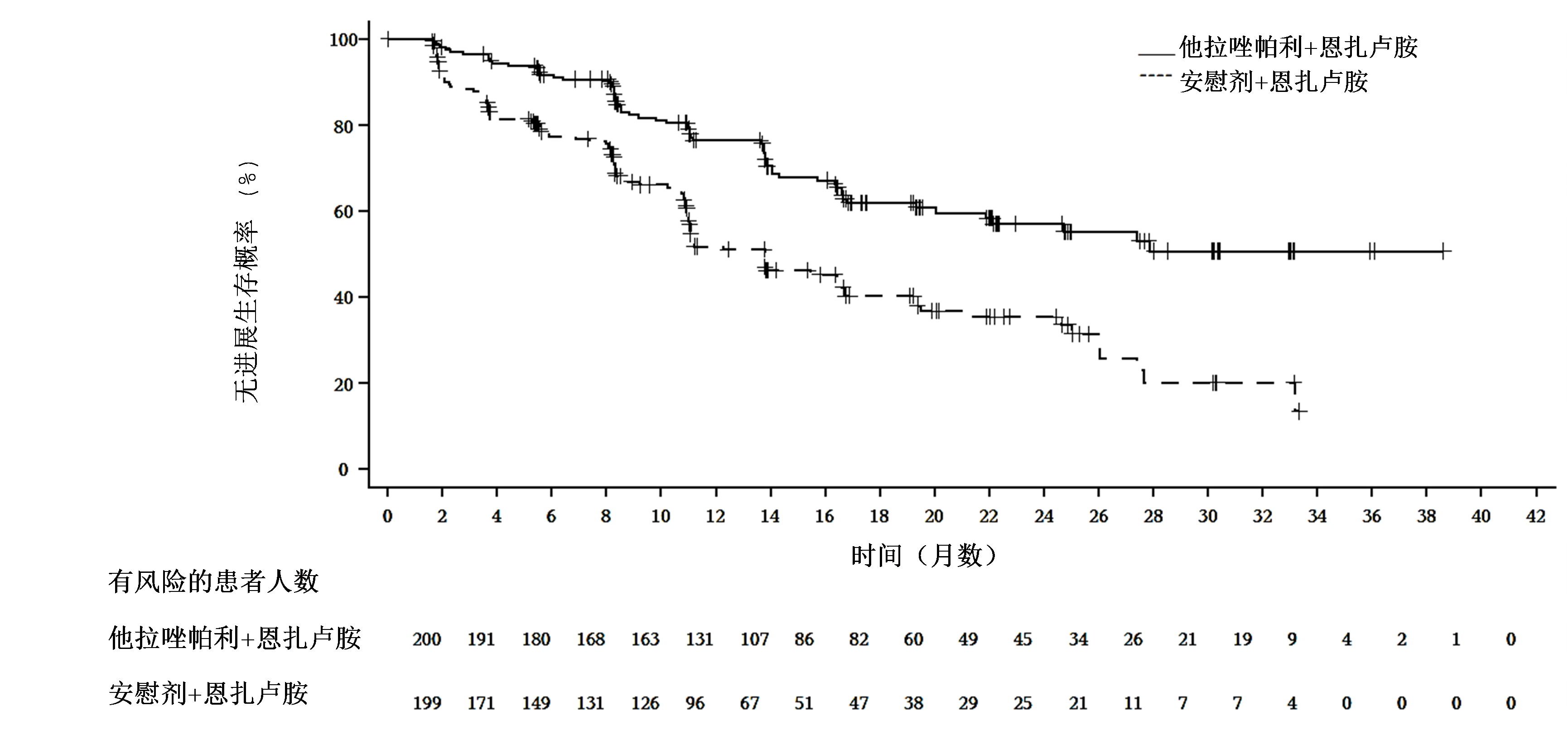
缩略词:HRRm = 同源重组修复基因突变型;mCRPC = 转移性去势抵抗性前列腺癌;rPFS = 影像学无进展生存期。
BRCA 突变型 (BRCAm) 和非BRCAm HRRm 患者的 rPFS 探索性亚组分析见表4。
表4 TALAPRO-2 研究中按 BRCAm 状态进行的探索性 rPFS 亚组分析(HRR 基因突变型 mCRPC)1
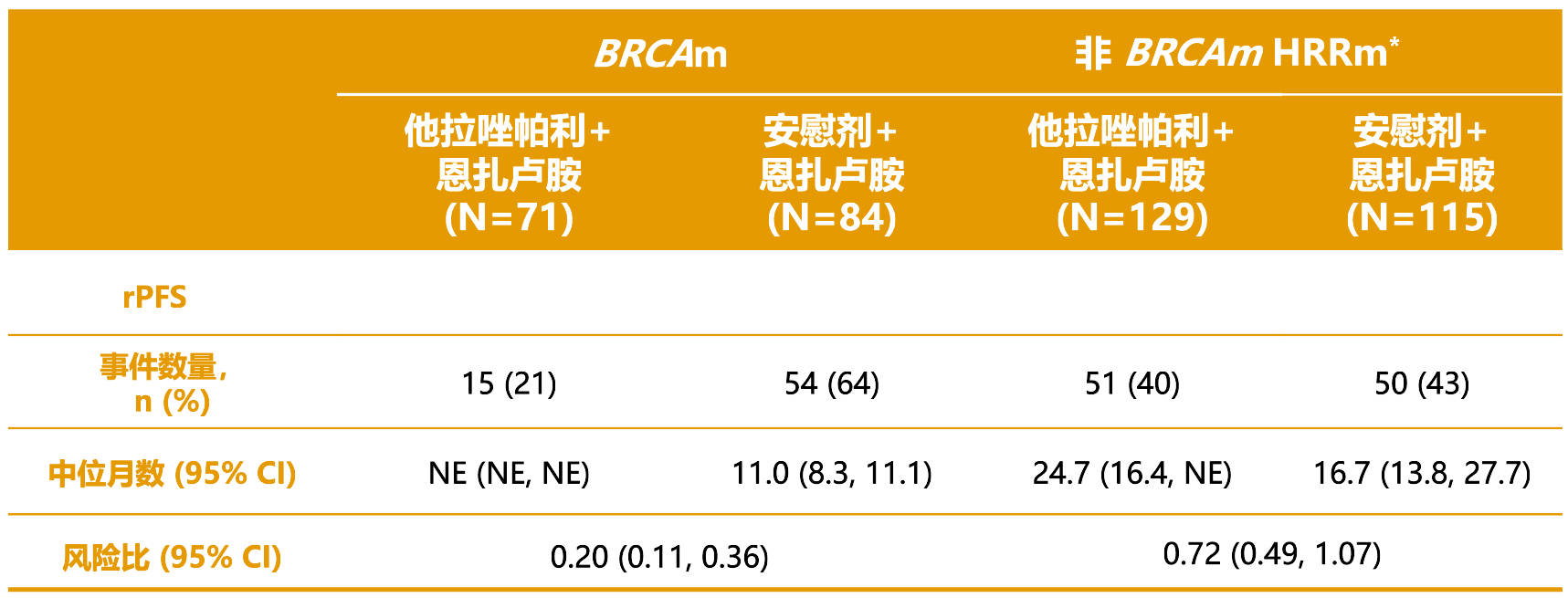
缩略词:BRCAm = 乳腺癌易感基因突变型;CI = 置信区间;HRRm = 同源重组修复基因突变型;NE = 不可评估;rPFS = 影像学无进展生存期。
* 包括 4 例非 HRR 基因突变型但被错误随机分配至 HRRm 分层的患者。
声明
关于他拉唑帕利更多详细信息请参见完整版药品说明书。
辉瑞公司无法针对个体患者不良事件的诊断和处理提出任何临床建议,应当由临床医生根据患者的具体请况作出合理判断和采取相应措施。
- 由于临床试验在不同的条件下完成,无法直接比较一种药物在临床试验中观察到的不良反应率和其他药物在临床试验中的不良反应率,且试验结果未必反映实际应用中的不良反应率。1
- 在入组 TALAPRO-2 研究的 HRR 基因突变型 mCRPC 患者中评估了本品与恩扎卢胺联合治疗的安全性(参见【临床试验】)。患者被随机分配接受本品 0.5 mg 联合恩扎卢胺 160 mg 每日一次 (n = 197) 或安慰剂联合恩扎卢胺 160 mg 每日一次 (n = 199),持续用药直至疾病进展或出现不可接受的毒性。在接受本品治疗的患者中,86% 的患者暴露 6 个月或更长,60% 的患者暴露 1 年以上,18% 的患者暴露 2 年以上。1
- 接受本品与恩扎卢胺联合治疗的患者中有 30% 发生严重不良反应。在 > 2% 的患者中报告的严重不良反应包括贫血 (9%) 和骨折 (3%)。1.5% 的患者发生致命不良反应,包括感染性肺炎、COVID 感染和脓毒症(各 1 例患者)。1
- 本品与恩扎卢胺联合治疗组中有 10% 的患者因不良反应而永久停用本品。导致永久停用本品的最常见不良反应为贫血 (4%)、疲劳、骨折、缺血性心脏病和脊髓压迫(各 1%)。1
- 本品与恩扎卢胺联合治疗组中有 58% 的患者因不良反应而中断本品给药。导致本品给药中断的最常见不良反应为贫血 (42%)、中性粒细胞减少症 (15%)、血小板计数降低 (9%) 和疲劳 (5%)。1
- 本品与恩扎卢胺联合治疗组中有 52% 的患者因不良反应而减少本品剂量。导致本品剂量减少的最常见不良反应为贫血 (43%)、中性粒细胞计数降低 (15%)、血小板计数降低 (6%) 和疲劳 (4%)。1
- 在接受本品和恩扎卢胺联合治疗的患者中,最常见 (≥ 10%) 的不良反应(包括实验室检查异常)为血红蛋白减少、中性粒细胞减少、淋巴细胞减少、疲劳、血小板减少、钙含量减少、恶心、食欲减退、钠减少、磷酸盐减少、骨折、镁减少、头晕、胆红素升高、钾减少和味觉倒错。1
表 5 和表 6 分别汇总了 TALAPRO-2 研究中的最常见不良反应和实验室检查异常。1
表 5. TALAPRO-2 研究中接受本品的患者报告的不良反应a (≥ 10%) [组间差异 ≥ 2%] 1
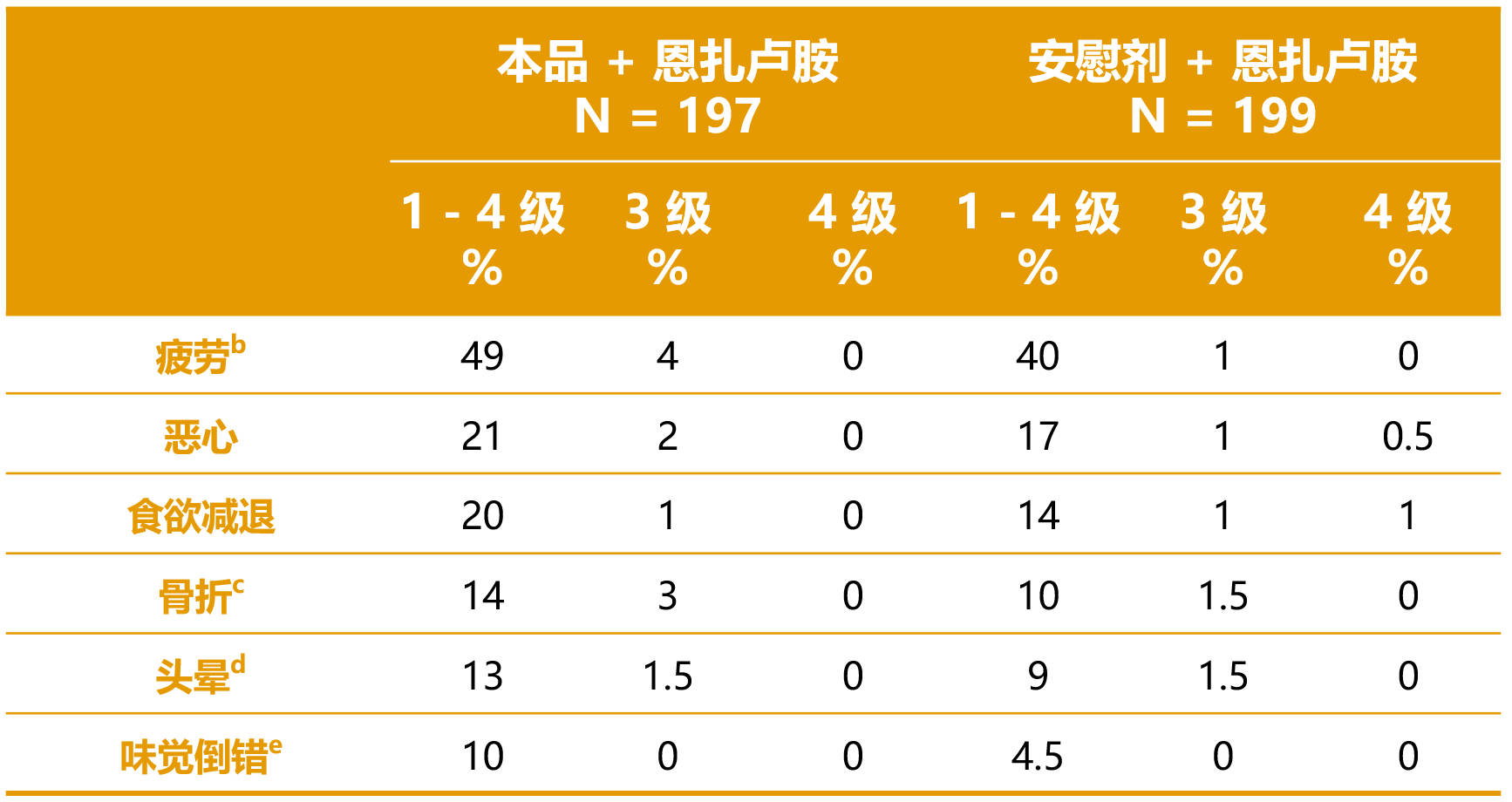
缩略词:N = 患者人数。
a 按 NCI CTCAE 4.03 分级。
b 包括疲劳和虚弱。
c 骨折包括多个类似术语。
d 包括头晕、体位性头晕、眩晕。
e 包括味觉丧失、嗅觉丧失、味觉倒错。
表 6. TALAPRO-2 研究中接受本品的患者报告的较基线恶化的选定实验室检查异常 (≥ 10%) 1
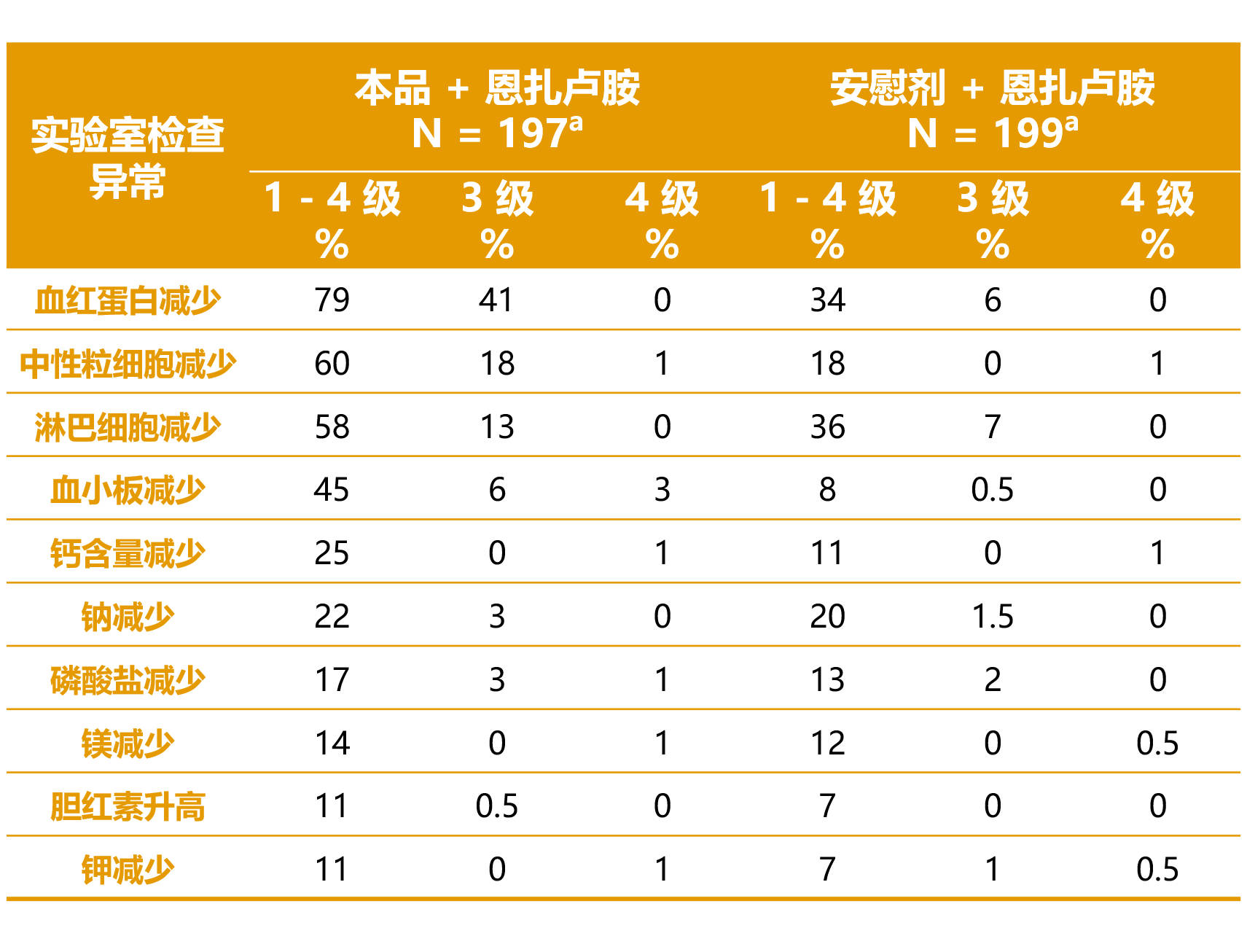
缩略词:N = 患者人数。
a 根据有基线值且有至少一个治疗后值的患者人数,安慰剂联合恩扎卢胺治疗组中用于计算比率的分母为 198 或 199 不等。
分级是把不良事件(AE)的严重程度进行归类。CTCAE在基于下述基础原则的基础上运用独特的临床描述将不良事件(AE)的严重程度分为1~5级。2

概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,41%患者发生3 或4级血红蛋白减少。1
处理策略1
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 血红蛋白 < 8g/dL | ≥ 9g/dL | 恢复本品给药时需要降低剂量 |
治疗管理
临床指南
NCCN造血生长因子管理指南对贫血的建议3
评估贫血的可能原因,如果发现,按指示治疗。如果未确定原因:
- 建议有症状的患者输注红细胞
- 对于近期强化化疗或放疗后血红蛋白(Hb)逐渐下降的高风险患者,或有合并症(心、慢性肺和脑血管疾病)的无症状患者,可考虑输注红细胞
- 浓缩红细胞是首选的血液制品
- 其他治疗选择包括某些患者的红细胞生成刺激剂 (ESA),并补充铁剂
血液和生物疗法促进协会 (AABB) 的红细胞输注阈值建议
Hb阈值为7g/dL:血流动力学稳定住院患者
Hb阈值为8g/dL:接受骨科手术或心脏手术的患者或既往患有心血管疾病的患者
专家共识4
专家共识对使用 PARPi + NHT 治疗转移性前列腺癌患者贫血管理的建议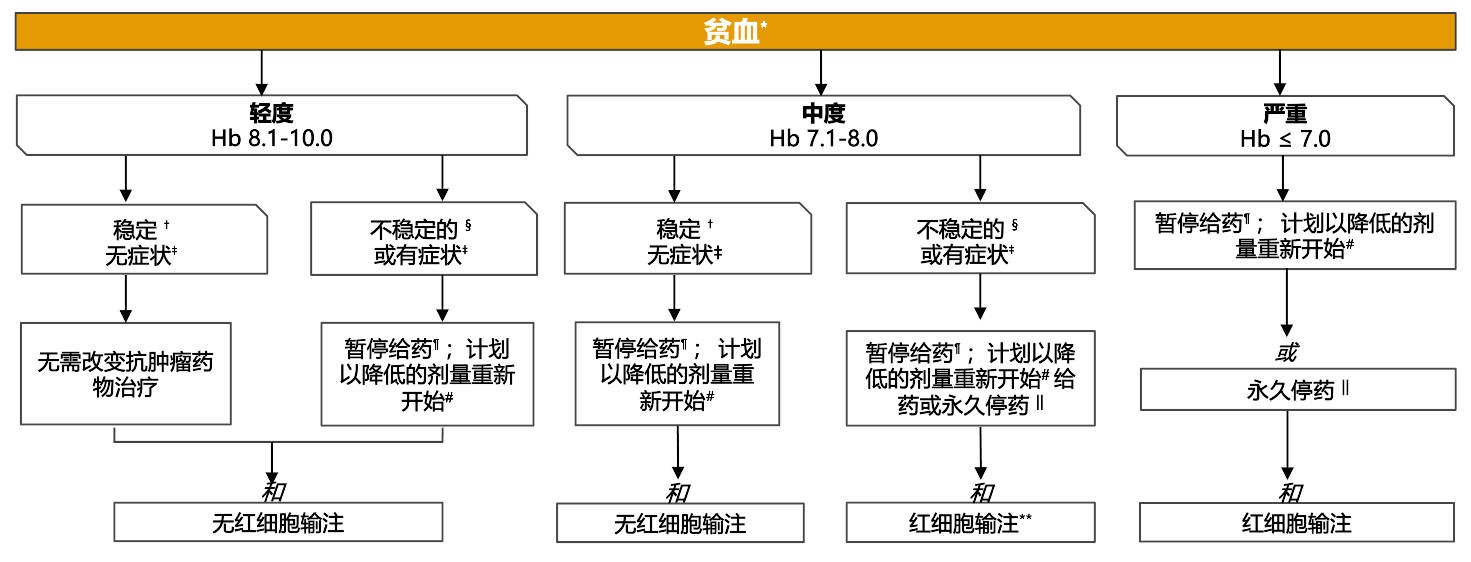
*根据 CTCAE V5.0 分级;假设主治医生确定不良事件是由NHT+PARPi 治疗引起的
† 例如,较治疗前基线不变或 <2g/dL
‡ 症状可能包括疲劳、虚弱、皮肤苍白、胸痛、心跳加快或呼吸短促、头痛、头晕、头昏眼花、手脚发冷、食欲不振
§ 例如,较治疗前基线下降 >2g/dL
¶ 所有可能导致血小板减少的药物
#是否重新开始治疗取决于患者的临床状态和相关检测结果
||必须仔细权衡治疗中止与潜在临床获益的关系,尤其是在 BRCA1/2 阳性的患者中
**无症状且无合并症(如心脏病、慢性肺病、脑血管疾病)的患者中,可能不需要输注红细胞
CTCAE :不良事件通用术语标准;Hb :血红蛋白;NHT :新型内分泌治疗;PARPi :多腺苷二磷酸核糖聚合酶抑制剂
概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,19%患者发生3 或4级中性粒细胞减少。1
处理策略
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 中性粒细胞计数 <1000/μL | ≥1500/μL | 恢复本品给药时需要降低剂量 |
治疗管理
临床指南
骨髓生长因子,如粒细胞集落刺激因子(G-CSF),刺激骨髓、增加白细胞生成 5,6
如果发生感染,酌情使用抗生素6
暂停抗肿瘤治疗,使白细胞数量恢复6
专家共识4
专家共识对使用 PARPi + NHT 治疗转移性前列腺癌患者中性粒细胞减少管理的建议
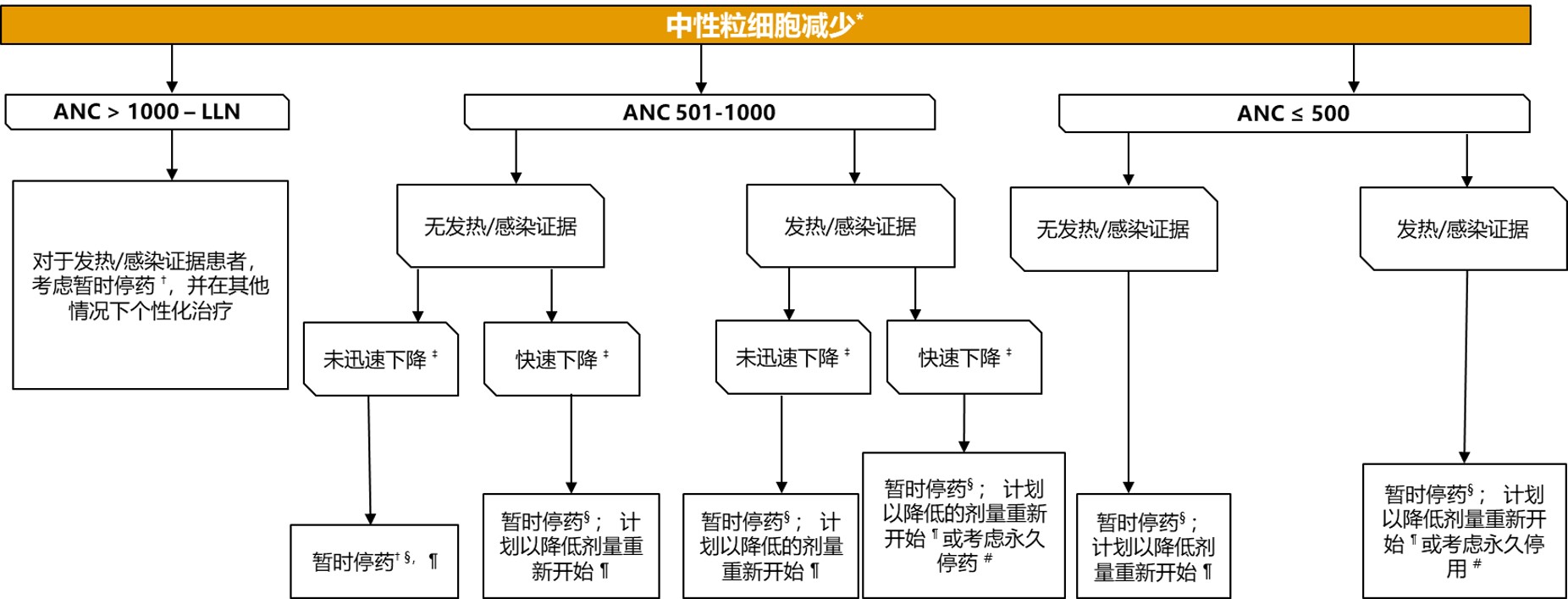
*临床指南定义的严重程度;假设主治医生确定不良事件是由NHT+PARPi 治疗引起的
†以相同或减少剂量重新开始取决于个体患者的情况
‡预计在未来 48 小时内降至 ≤500 个中性粒细胞/mcL
§所有可能导致中性粒细胞减少的药物
¶是否重新开始治疗取决于患者的临床状态和相关检测结果
#必须仔细权衡中止治疗与潜在临床获益的关系,特别是在 BRCA1/2 阳性的患者中
ANC :中性粒细胞绝对计数;LLN : 正常值下限;NHT : 新型内分泌治疗;PARPi :多腺苷二磷酸核糖聚合酶抑制剂
概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,9%患者发生3 或4级血小板减少。1
处理策略
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 血小板计数 <5,000/μL | ≥75,000/μL | 恢复本品给药时需要降低剂量 |
治疗管理
临床指南
NCCN造血生长因子管理指南对血小板减少的建议3
在疑似化疗诱导的血小板减少症(CIT) 中,评估其他潜在原因,如果发现,按指示治疗潜在原因:
如果确定为 CIT,请考虑:
- 根据血液和生物疗法促进协会(AABB)指南进行血小板输注
- 减少剂量或改变治疗方案
专家共识4
专家共识对使用 PARPi + NHT 治疗转移性前列腺癌患者血小板减少管理的建议
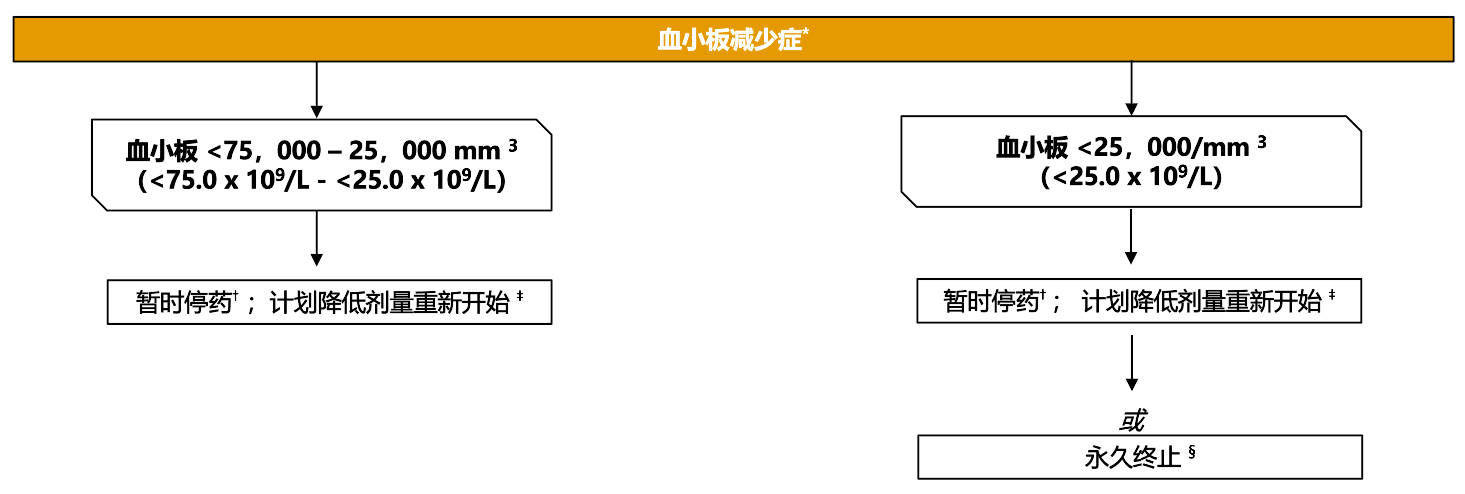
*严重程度依据CTCAE V3.0分级;假设主治医生确定不良事件是由NHT+PARPi 治疗引起的
†所有可能导致血小板减少的药物
‡是否重新开始治疗取决于患者的临床状态和相关检测结果
§必须仔细权衡中止治疗与潜在临床获益的关系,特别是在 BRCA1/2 阳性的患者中
CTCAE : 不良事件通用术语标准;NHT : 新型内分泌治疗; PARPi :多腺苷二磷酸核糖聚合酶抑制剂
概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,4%患者发生3 或4级疲劳。1
AE分级信息2
根据CTCAE标准判断的【疲劳】分级

根据CTCAE4.0(不良事件术语标准4.0版)进行分级,短横线(-)意味着不存在该分级
*日常家务生活(Instrumental ADL):指做饭、购买杂货或衣物、打电话、理财等
**日常生活自理能力(Self-care ADL):是指能够洗澡、穿衣脱衣、进食、如厕、服用药物且不会卧床不起
处理策略1
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 3级或4级AE | ≥1级 | 恢复本品给药时需要降低剂量或者停药 |
治疗管理
临床指南
NCCN肿瘤相关疲劳管理指南的建议7
非药物干预:
- 体力活动
- 按摩疗法
- 针灸
- 心理社会干预,如认知行为治疗 (CBT)
- 营养咨询
- 失眠认知行为治疗
- 光照治疗
药物干预:
- 某些患者的精神兴奋剂(哌甲酯)
CBT = 认知行为治疗;NCCN = 美国国家综合癌症网络
专家共识4
专家共识对使用 PARPi + NHT 治疗转移性前列腺癌患者疲劳管理的建议
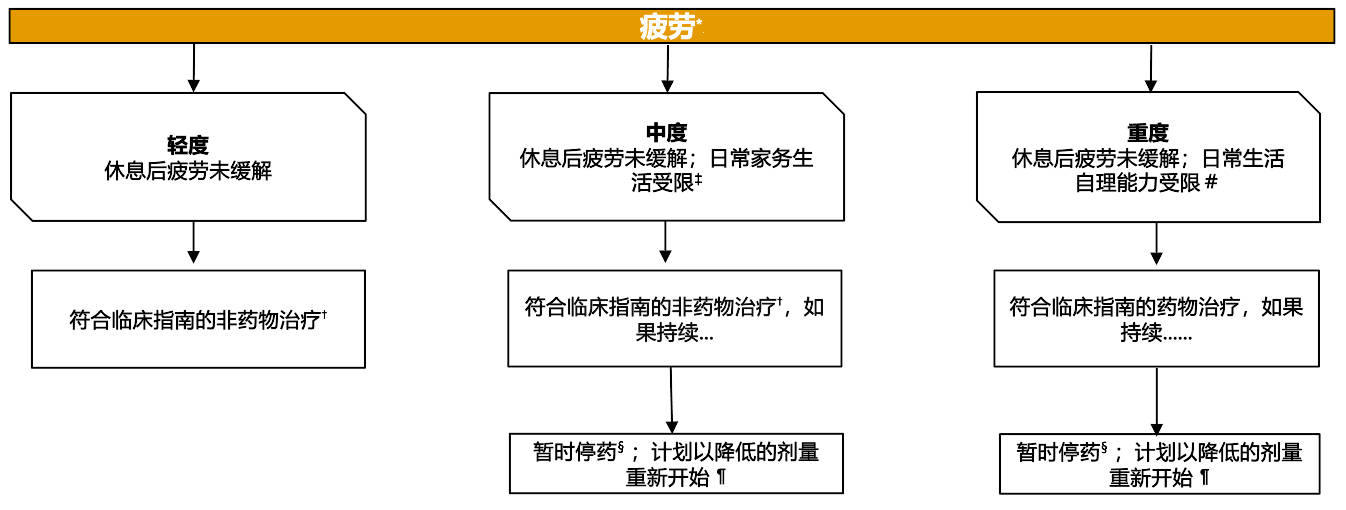
*严重程度根据 CTCAE V5.0 分级。假设主治医生确定不良事件是由NHT+PARPi 治疗引起的
†例如,体力活动、瑜伽、按摩疗法、CBT、BT、心理教育疗法、教育疗法
‡日常家务生活是指做饭、购买杂货或衣物、打电话、理财等
§所有可能导致疲劳的药物
¶是否重新开始治疗取决于患者的临床状态和相关检测结果
#日常生活自理能力是指能够洗澡、穿衣脱衣、进食、如厕、服用药物且不会卧床不起
BT:行为治疗;CBT:认知行为治疗;CTCAE:不良事件通用术语标准;NHT:新型内分泌治疗;PARPi:多腺苷二磷酸核糖聚合酶抑制剂
概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,2%患者发生3 或4级恶心。1
AE分级信息2
根据CTCAE标准判断的【恶心】分级

根据CTCAE4.0(不良事件术语标准4.0版)进行分级,短横线(-)意味着不存在该分级
处理策略1
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 3级或4级AE | ≥1级 | 恢复本品给药时需要降低剂量或者停药 |
治疗管理
临床指南
NCCN肿瘤相关恶心管理指南的建议8
在某些患者中,在抗肿瘤治疗前开始每天使用止吐药,如甲氧氯普胺、丙氯拉嗪或 5-羟色胺3受体拮抗剂预防呕吐
恶心/呕吐发作时,可添加其他不同类别的药物:
- 奥氮平(非典型抗精神病药)
- 劳拉西泮(苯二氮䓬类)
- 大麻酚胶囊(大麻素)
- 其他:氟哌啶醇、甲氧氯普胺、东莨菪碱
- 丙氯拉嗪或异丙嗪(吩噻嗪)
- 多拉司琼、格拉司琼或昂丹司琼 (5-羟色胺3受体拮抗剂)
- 地塞米松(皮质类固醇)
专家共识4
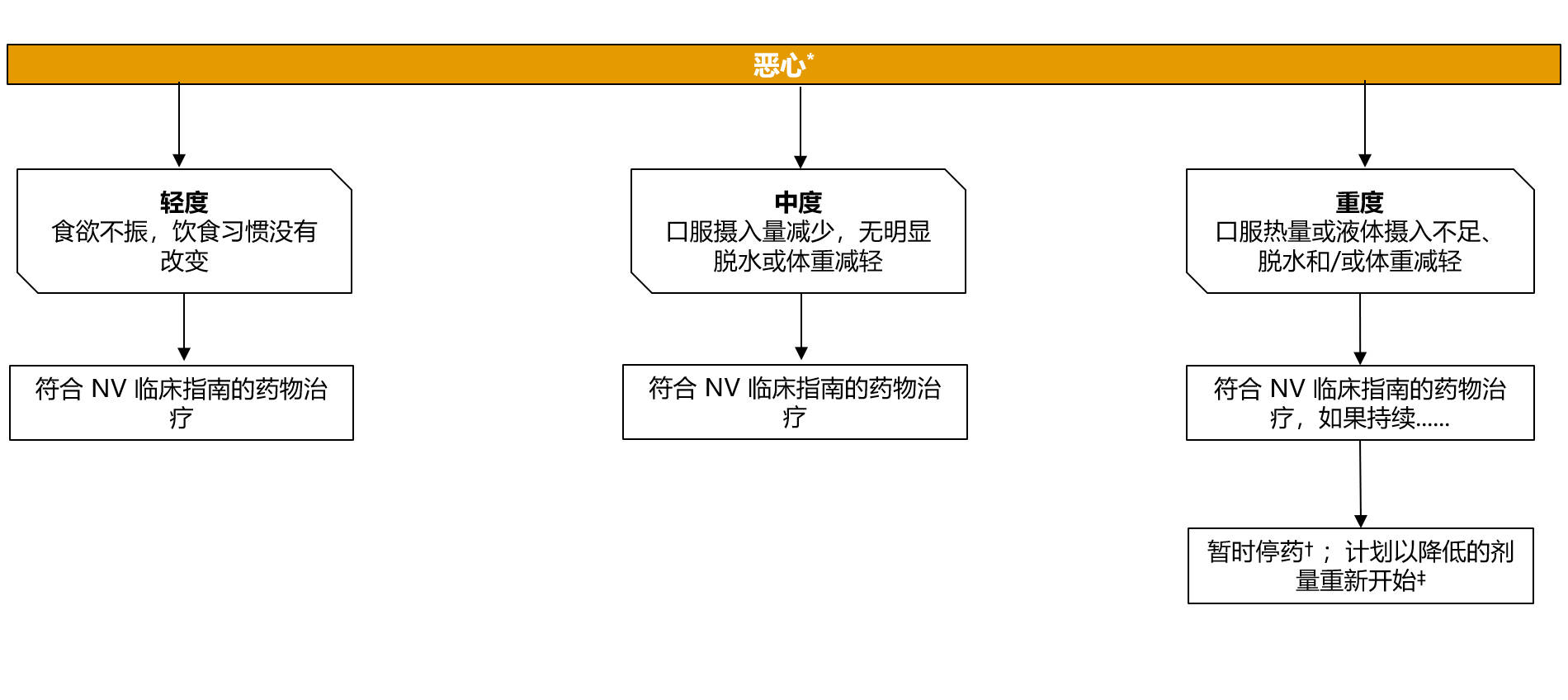
专家共识对使用 PARPi + NHT 治疗转移性前列腺癌患者恶心管理的建议
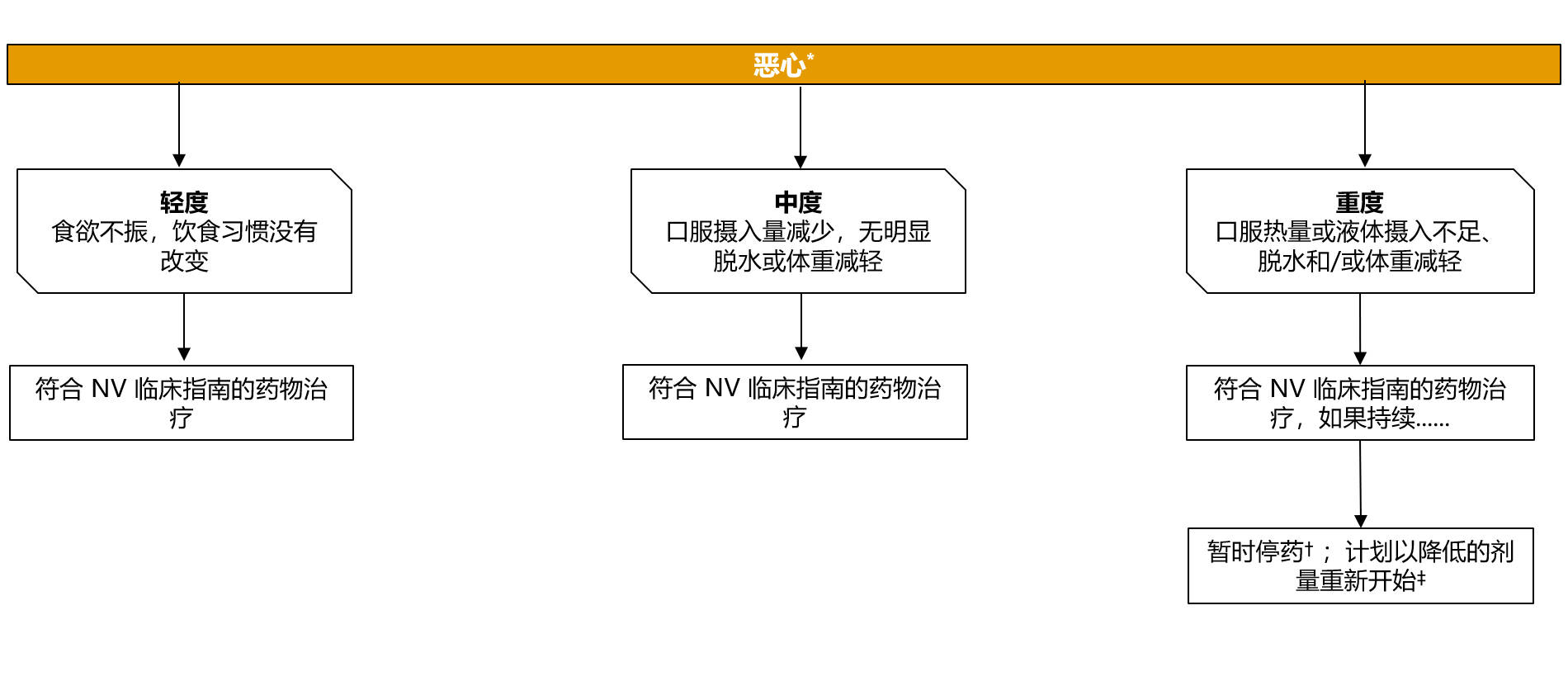
*严重程度根据 CTCAE V4.0 和 V5.0 分级;假设主治医生确定不良事件是由NHT+PARPi 治疗引起的
†所有可能导致恶心的药物
‡是否重新开始治疗取决于患者的临床状态和相关检测结果
NHT:新型内分泌治疗;NV:恶心和呕吐;PARPi:多腺苷二磷酸核糖聚合酶抑制剂
概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,3%患者发生3 或4级骨折。1
AE分级信息2
根据CTCAE标准判断的【骨折】分级

处理策略1
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 3级或4级AE | ≥1级 | 恢复本品给药时需要降低剂量或者停药 |
概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,1.5%患者发生3 或4级头晕。1
AE分级信息2
根据CTCAE标准判断的【头晕】分级

根据CTCAE4.0(不良事件术语标准4.0版)进行分级,短横线(-)意味着不存在该分级
*日常家务生活(Instrumental ADL):指做饭、购买杂货或衣物、打电话、理财等
**日常生活自理能力(Self-care ADL):是指能够洗澡、穿衣脱衣、进食、如厕、服用药物且不会卧床不起
处理策略1
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 3级或4级AE | ≥1级 | 恢复本品给药时需要降低剂量或者停药 |
概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,1%患者发生3 或4级食欲不振。1
AE分级信息2
根据CTCAE标准判断的【食欲不振】分级

处理策略1
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 3级或4级AE | ≥1级 | 恢复本品给药时需要降低剂量或者停药 |
概况
在接受本品和恩扎卢胺联合治疗的患者(n=197)中,没有患者发生3 或4级味觉倒错,10%患者发生1 或2级味觉倒错。1
AE分级信息2
根据CTCAE标准判断的【味觉倒错】分级

根据CTCAE4.0(不良事件术语标准4.0版)进行分级,短横线(-)意味着不存在该分级
处理策略1
| 不良反应 | 暂停服用本品直至水平恢复至 | 恢复本品给药 |
|---|---|---|
| 3级或4级AE | ≥1级 | 恢复本品给药时需要降低剂量或者停药 |
- EAU - EANM - ESTRO -ESUR - ISUP - SIOG Guidelines on Prostate Cancer. 查看全文
- NCCN Clinical Practice Guidelines in Oncology: Prostate Cancer. 查看全文
- ESTRO ACROP guideline on prostate bed delineation for postoperative radiotherapy in prostate cancer. 查看全文
- Salvage Therapy for Prostate Cancer: AUA/ASTRO/SUO Guideline Part I: Introduction and Treatment Decision-Making at the Time of Suspected Biochemical Recurrence after Radical Prostatectomy. 查看全文
- 2023 Canadian Urological Association guideline: Genetic testing in prostate cancer. 查看全文
- Addressing the risk and management of cardiometabolic complications in prostate cancer patients on androgen deprivation therapy and androgen receptor axis-targeted therapy: consensus statements from the Hong Kong Urological Association and the Hong Kong Society of Uro-Oncology. 查看全文
- Updates to Advanced Prostate Cancer: AUA/SUO Guideline (2023). 查看全文
- 2022 Canadian Urological Association (CUA)-Canadian Uro Oncology Group (CUOG) guideline: Management of castration-resistant prostate cancer (CRPC). 查看全文
- Updated treatment recommendations for prostate cancer from the ESMO Clinical Practice Guideline considering treatment intensification and use of novel systemic agents. 查看全文
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
请注意:我们不建议超出国家药品监督管理局批准的药品说明书的应用或未在中国(不含港澳台)上市药品的应用。如我们所提供的文献信息及指南共识涉及该等内容,系出于传递科学知识的需要,不应视为对未在中国(不含港澳台)上市药品或已在中国上市但超出国家药品监督管理局批准的药品说明书的药品适应症/用法的推广。
1. 泰泽纳(甲苯磺酸他拉唑帕利胶囊)说明书
2. National Cancer Institute. CTCAE v.4.0. Available at: https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03/CTCAE_4.03_2010-06-14_QuickReference_8.5x11. Accessed Oct 2024.
3. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)Hematopoietic Growth Factors. 2024.V3
4. Shore ND, Broder MS, Barata PC, et al. Expert Consensus Recommendations on the Management of Treatment-emergent Adverse Events Among Men with Prostate Cancer Taking Poly-ADP Ribose Polymerase Inhibitor + Novel Hormonal Therapy Combination Therapy. Eur Urol Oncol. Published online June 11, 2024.
5. Mehta HM, Malandra M, Corey SJ. G-CSF and GM-CSF in Neutropenia. J Immunol. 2015, 195(4):1341-1349.
6. Low white blood cell counts (neutropenia). American Cancer Society. https://www.cancer.org/treatment/treatments-and-side-effects/physical-side-effects/low-blood-counts/neutropenia.html. Accessed Oct, 2024.
7. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)Cancer-Related Fatigue.2024.V2
8. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®)Antiemesis.2024.V1



