请仔细阅读说明书并在医师指导下使用
本品适用于成人有或无先兆偏头痛的急性治疗。
75mg(按C28H28F2N6O3计)
推荐剂量为每次口服75mg ,按需服药,每日不超过一次。
本品可随餐或不随餐服用。尚未确定在30天内使用超过18次的安全性。
给药说明:
- 打开泡罩包装时,请先将手擦干。
- 揭开泡罩的铝箔,轻轻取出口崩片。
- 不可通过铝箔推出口崩片。
- 一旦打开泡罩,尽快取出口崩片并置于舌上或舌下。
- 口崩片将在唾液中崩解,因此可以在无需饮水的情况下吞咽。
- 打开泡罩包装后立即服用,备用时请勿将口崩片贮存在泡罩包装外。
合并用药:
当本品与CYP3A4 中效抑制药物或P-糖蛋白(P-gp)强效抑制剂(参见【药物相互作用】)合并使用时,应避免在48小时内再次给予本品。
肾功能损害:
轻度、中度或重度肾功能损害患者无需调整用药剂量。重度肾功能损害导致未结合瑞美吉泮的血浆浓度曲线下面积(AUC)增加>2倍,但总AUC 增加小于50%(参见【临床药理】)。重度肾功能损害患者频繁使用本品时应谨慎。尚未在终末期肾病患者和透析患者中开展瑞美吉泮的研究。终末期肾病(肌酐清除率[CLcr]<15mL/min)患者应避免使用瑞美吉泮。
肝功能损害:
轻度(Child-Pugh A)或中度(Child-Pugh B)肝功能损害患者无需调整剂量。重度(Child-Pugh C)肝功能损害受试者的瑞美吉泮血浆浓度(未结合瑞美吉泮的AUC)显著增高(参见【临床药理】)。重度肝功能损害患者应避免使用瑞美吉泮。
本品用于偏头痛急性治疗时最常见的不良反应为恶心(1.2%)。多数严重程度为轻或中度。接受治疗的患者中超敏反应(包括呼吸困难和严重皮疹)的发生率低于1%。
按MedDRA 系统器官分类列出的不良反应见表1。根据以下常规分类方法,对每种药物不良反应的发生率进行分类(CIOMS III):十分常见(≥1/10);常见(≥1/100至<1/10);偶见(≥1/1,000至<1/100);罕见(≥1/10,000至<1/1,000);非常罕见(<1/10,000)。
表1. 不良反应列表
| 系统器官分类 | 不良反应 | 发生率 |
|---|---|---|
| 免疫系统疾病 | 超敏反应,包括呼吸困难和严重皮疹 | 偶见 |
| 胃肠系统疾病 | 恶心 | 常见 |
长期安全性
在两项为期1年、开放标签的延伸试验中评估了瑞美吉泮的长期安全性;1662例患者接受了至少6个月的瑞美吉泮治疗,740例患者接受了12个月的瑞美吉泮治疗。
超敏反应
在临床研究接受治疗的患者中,超敏反应(包括呼吸困难和重度皮疹)的发生率低于1%,超敏反应可发生在给药后数天,也发生过迟发型严重超敏反应。
对活性成份瑞美吉泮或任何辅料过敏者禁用。
临床研究中,接受瑞美吉泮治疗的患者中超敏反应(包括呼吸困难和皮疹)的发生率低于1%,超敏反应(包括严重超敏反应)可发生在给药后数天。如果发生超敏反应,应停用瑞美吉泮并给予适当治疗。
下列情况不建议使用本品:
- 重度肝功能损害患者(参见【用法用量】);
- 终末期肾病患者(CLcr<15mL/min)(参见【用法用量】);
- 合并使用强效CYP3A4 抑制剂的患者(参见【药物相互作用】);
- 合并使用强效或中效CYP3A4 诱导剂的患者(参见【药物相互作用】)。
药物过量性头痛(MOH)
过量使用任何类型的药物治疗头痛均可导致其恶化。如果已出现或怀疑出现这种情况,应立即就医,并停止治疗。对于频繁出现或每日发作的头痛,即使已经常规使用药物治疗急性头痛,或由于常规使用药物导致头痛,均应考虑MOH的诊断。
妊娠:
妊娠妇女服用瑞美吉泮的数据有限。
动物研究表明,瑞美吉泮没有胚胎致死作用,且在临床相关暴露量下未观察到致畸风险。在妊娠期间给予瑞美吉泮后,仅在与母体毒性相关的暴露水平(约为临床暴露量的200倍)下观察到对胚胎-胎仔发育的不良影响(大鼠胎仔体重下降和骨骼变异增加)(参见【药理毒理】)。
作为预防措施,建议在妊娠期间避免使用本品。
哺乳期:
在一项单中心研究中,12名哺乳期女性接受了单次75mg 瑞美吉泮的给药,在她们的乳汁中仅检出极低浓度的瑞美吉泮。相对婴儿剂量(RID)不足1%。
目前尚没有关于母乳分泌量是否会受到影响的数据,临床使用时应考虑母乳喂养对发育和健康的获益,以及母亲对本品的临床需求,以及瑞美吉泮或母体基础疾病对母乳喂养婴儿的任何潜在不良反应。
生育能力:
动物研究显示本品对雌性和雄性生育能力无临床相关的影响(参见【药理毒理】)。
尚未确定本品在<18岁未成年人群中的安全性和疗效。
在65岁或以上患者中使用瑞美吉泮的经验有限。药代动力学研究未观察到老年和年轻受试者之间存在具有临床意义的药代动力学差异。
瑞美吉泮是CYP3A4、P-gp 和乳腺癌耐药蛋白(BCRP)外排转运蛋白的底物。
CYP3A4 抑制剂
CYP3A4 抑制剂可增加瑞美吉泮的血浆浓度。不建议将瑞美吉泮与强效CYP3A4 抑制剂(例如,克拉霉素、伊曲康唑、利托那韦)合并使用(参见【注意事项】)。与伊曲康唑合并给药会导致瑞美吉泮暴露量显著增加(AUC 增加4倍和Cmax 增加1.5倍)。
与CYP3A4 中效抑制药物(例如,地尔硫卓、红霉素、氟康唑)合并使用可能会增加瑞美吉泮的暴露量。与氟康唑合并使用会导致瑞美吉泮暴露量增加(AUC 增加1.8倍),但对Cmax 无相关影响。如果与CYP3A4 中效抑制剂(如氟康唑)合并使用,应避免在48小时内再次给予瑞美吉泮。
CYP3A4 诱导剂
CYP3A4 诱导剂可降低瑞美吉泮的血浆浓度。不建议瑞美吉泮与强效CYP3A4 诱导剂(例如,苯巴比妥、利福平、圣约翰草(贯叶连翘))或中效CYP3A4 诱导剂(例如,波生坦、依非韦伦、莫达非尼)合并使用。CYP3A4 诱导作用可在停用强效或中效CYP3A4 诱导剂后持续长达2周。利福平与瑞美吉泮合并使用导致瑞美吉泮暴露量显著降低(AUC 降低80%,Cmax 降低64%),从而可能导致疗效丧失。
P-gp 和BCRP 抑制剂
P-gp 和BCRP 外排转运蛋白的抑制剂可能会增加瑞美吉泮的血浆浓度。瑞美吉泮与P-gp 强效抑制剂(例如,环孢素、维拉帕米、奎尼丁)合并使用时,应避免在48小时内再次给药(参见【用法用量】)。与环孢霉素(一种强效P-gp 和BCRP 抑制剂)或奎尼丁(一种选择性P-gp 抑制剂)合并使用时,瑞美吉泮的暴露量出现相似幅度的显著增加(AUC 和Cmax 增加>50%,但低于2倍)。
有关瑞美吉泮用药过量的临床经验有限,尚未有用药过量的症状报道。
对瑞美吉泮用药过量的治疗,应包括监测患者生命体征和观察临床状况等一般辅助措施。
目前尚无治疗瑞美吉泮用药过量的特异性解毒剂。由于血清蛋白结合率较高,瑞美吉泮不能通过透析被显著清除。
药效学
尚不清楚瑞美吉泮的药效学活性与其临床作用机制之间的关系。
药代动力学
吸收
口服给药后,瑞美吉泮在1.5小时达到最大浓度。以300mg 的超治疗范围剂量给药后,瑞美吉泮的绝对口服生物利用度约为64%。
食物的影响
在高脂或低脂餐后条件下给予瑞美吉泮后,Tmax 延迟1-1.5小时。高脂餐可使Cmax 降低42-53%,AUC 降低32-38%。低脂餐使Cmax 降低36%,AUC 降低28%。在评价安全性和有效性的临床试验中,服用瑞美吉泮时未限制餐食。
分布
瑞美吉泮的稳态分布容积为120L。瑞美吉泮的血浆蛋白结合率约为96%。
生物转化
瑞美吉泮主要通过CYP3A4 代谢,少量通过CYP2C9 代谢。在血浆中瑞美吉泮主要以原型存在(约77%),未检测到主要代谢物(即含量>10%)。
体外研究显示,临床相关浓度下瑞美吉泮不是CYP1A2、2B6、2C9、2C19、2D6 或UGT1A1 的抑制剂。然而,瑞美吉泮是CYP3A4 的弱抑制剂,具有时间依赖性抑制作用。临床相关浓度下,瑞美吉泮不是CYP1A2、CYP2B6 或CYP3A4 的诱导剂。
消除
在健康受试者中,瑞美吉泮的消除半衰期约为11小时。健康男性受试者口服[14C]-瑞美吉泮后,总放射性的78%经粪便回收,24%经尿液回收。原型瑞美吉泮是排泄粪便(42%)和尿液(51%)中的主要单一组分。
转运蛋白
体外研究显示,瑞美吉泮是P-gp 和BCRP 外排转运蛋白的底物。P-gp 和BCRP 外排转运蛋白抑制剂可能会增加瑞美吉泮的暴露量(参见【药物相互作用】)。
瑞美吉泮不是OATP1B1 或OATP1B3 的底物。考虑到其肾脏清除率较低,未对瑞美吉泮是否为OAT1、OAT3、OCT2、MATE1 或MATE2-K 的底物进行评价。
临床相关浓度下瑞美吉泮不是P-gp、BCRP、OAT1 或MATE2-K 的抑制剂,是OATP1B1 和OAT3 的弱抑制剂。
瑞美吉泮是OATP1B3、OCT2 和MATE1 的抑制剂。瑞美吉泮与二甲双胍(一种MATE1转运蛋白底物)合并使用,对二甲双胍的药代动力学或葡萄糖利用均无临床显著影响。临床相关浓度下,预计瑞美吉泮与OATP1B3 或OCT2 无临床药物相互作用。
线性/非线性
单次经口给药(25mg 至1500mg)后,瑞美吉泮的暴露量增加比例大于剂量增加比例,该变化似乎与生物利用度的剂量依赖性增加有关。
年龄、性别、体重、人种、种族
根据年龄、性别、人种/种族、体重、偏头痛状态或CYP2C9 基因型,未观察到瑞美吉泮的药代动力学存在临床显著差异。
肾功能损害
在一项专门的临床研究中,分别将轻度(CLcr 60-89mL/min)、中度(CLcr 30-59mL/min)和重度(CLcr 15-29mL/min)肾功能损害受试者与汇总的健康对照受试者中瑞美吉泮的药代动力学数据进行了比较,结果显示75mg 单次给药后,在轻、中度肾功能损害受试者中,总瑞美吉泮的暴露量(AUC)增加不到50%。在重度肾功能损害受试者中,未结合瑞美吉泮的暴露量(AUC)是健康受试者的2.57倍。尚未在终末期肾病(CLcr<15mL/min)患者中进行研究。
肝功能损害
在一项专门的临床研究中比较了轻度、中度和重度肝功能损害受试者与各组相匹配的健康对照受试者中瑞美吉泮的药代动力学数据,结果表明与肝功能正常的健康受试者相比,重度肝功能损害(Child-Pugh C 级)受试者接受瑞美吉泮75mg 单次给药后的暴露量(未结合AUC)是健康受试者的3.89倍。轻度(Child-Pugh A 级)和中度肝功能损害(Child-Pugh B 级)受试者中,瑞美吉泮的暴露量没有临床意义的差异。
遗传药理学
CYP2C9 的活性在某些基因变异型(如具有CYP2C9*2和CYP2C9*3等位基因)个体中降低。CYP2C9 中等代谢型(即*1/*2、*2/*2、*1/*3,n = 43)与正常代谢型(即*1/*1,n = 72)人群中,瑞美吉泮的Cmax 和AUC0-inf 相似。CYP2C9 慢代谢型人群(即*2/*3)没有足够的PK 数据。CYP2C9 对瑞美吉泮代谢的影响被认为较小,因此预期CYP2C9 的基因多态性不会显著影响瑞美吉泮的暴露量。
在两项关键的随机、双盲、安慰剂对照的确证性临床试验评价了75mg瑞美吉泮口崩片用于有或无先兆偏头痛成人患者急性治疗的疗效:研究1和研究2。
两项研究设计大致相同。研究持续时间长达11周,包括筛选期、急性治疗期(最长达45天,该阶段对达到中度或重度的偏头痛进行1次治疗)和治疗结束访视。纳入合格受试者按1:1比例随机接受硫酸瑞美吉泮口崩片75mg或安慰剂治疗,共同主要终点为给药后2小时无疼痛率和给药后2小时无最困扰的偏头痛相关症状(MBS)率。无疼痛定义为中或重度头痛减轻至无头痛,无MBS定义为无自我识别的MBS(即畏光、畏声或恶心)。研究1在美国患者中开展,1351例患者接受本品(N= 669)或安慰剂(N = 682)治疗并纳入疗效分析。研究2在中国和韩国患者中开展,1340例患者接受本品(N = 666)或安慰剂(N = 674)治疗并纳入疗效分析。患者在指导下接受1次中至重度偏头痛发作的治疗。首次治疗2小时后允许使用挽救药物(即非甾体抗炎药物(NSAIDs),对乙酰氨基酚,和/或止吐药)。在首次治疗后48小时内不允许使用其他形式的挽救药物,如曲坦类药物。研究1基线时大约14%的患者服用偏头痛预防药物,研究2基线时大约5%的患者服用偏头痛预防药物。研究1和2中均没有患者合并使用作用于CGRP 通路的预防药物。研究1中,在伴有MBS的患者中,最常见的症状是畏光(54%),其次是恶心(28%)和畏声(15%)。研究2中,在伴有MBS的患者中,最常见的症状是恶心(54.4%),其次是畏声(26.4%)和畏光(19.1%)。
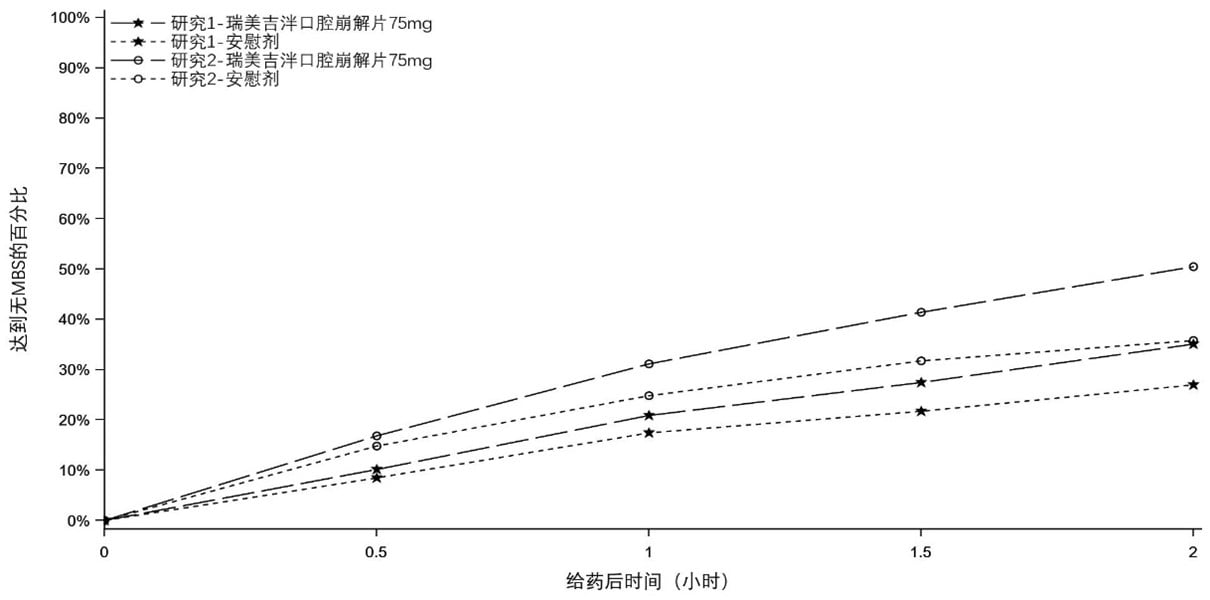
两项研究都对接受一次中至重度偏头痛治疗的患者进行了主要疗效分析。在两项研究中,与安慰剂组相比,接受硫酸瑞美吉泮口崩片治疗的患者在单次给药后2小时达到无疼痛和无MBS 的患者比例均达到统计学意义的显著升高。(表2,图1和图2)。
表2. 研究1和研究2中偏头痛急性治疗的主要疗效终点
| 研究1# | 研究2# | |||
|---|---|---|---|---|
| 给药后2 小时无疼痛 | ||||
| 给药后2 小时无MBS | ||||
| 瑞美吉泮口崩片 75mg | 安慰剂 | 瑞美吉泮口崩片 75mg | 安慰剂 | |
| n/N* | 142/669 | 74/682 | 132/666 | 72/674 |
| 应答率(%) | 21.2 | 10.9 | 19.8 | 10.7 |
| 与安慰剂相比的差值(%) | 10.3 | 9.2 | ||
| p 值 | <0.0001a | <0.0001a | ||
| n/N* | 235/669 | 183/682 | 336/666 | 241/674 |
| 应答率(%) | 35.1 | 26.8 | 50.5 | 35.8 |
| 与安慰剂相比的差值(%) | 8.3 | 14.8 | ||
| p 值 | 0.0009a | <0.0001a | ||
*n = 应答者人数/N = 该治疗组的患者人数
a具有统计学显著意义的p 值
#研究1:美国研究(NCT03461757);研究2:亚洲研究(中国+韩国,NCT04574362)
图1. 研究1和研究2中给药2小时内达到无疼痛的患者比例
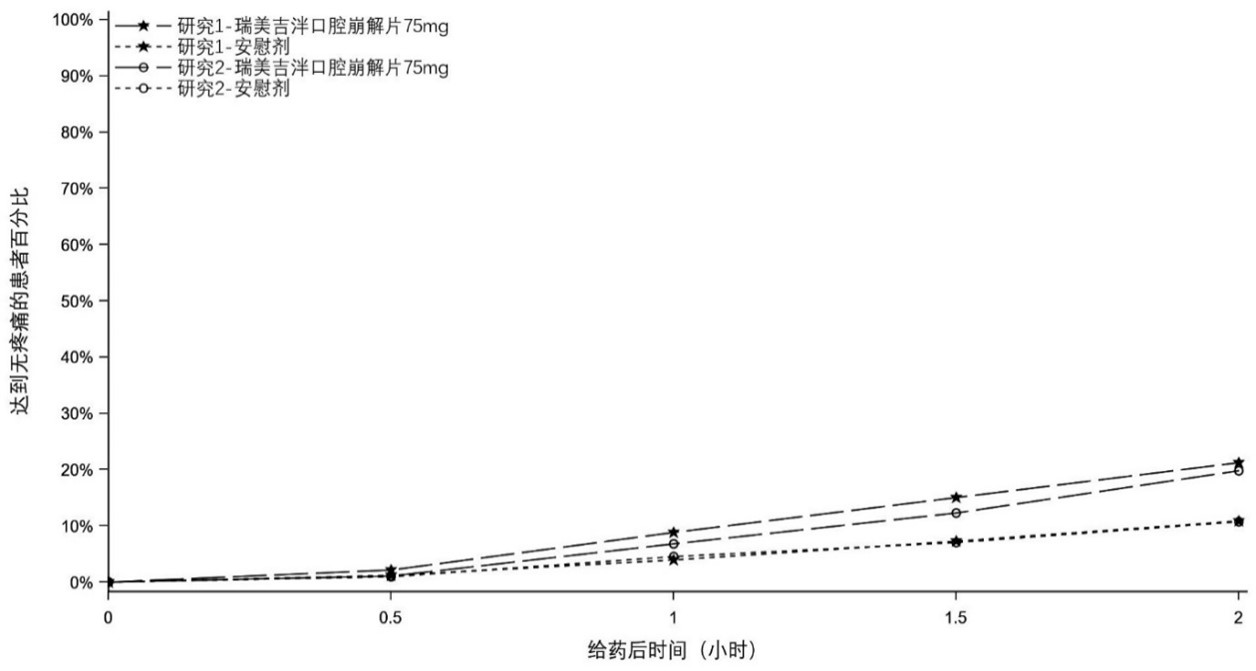
图2. 研究1和研究2中给药2小时内达到无MBS 的患者比例
在两项研究中,与安慰剂相比,本品在其他疗效终点(给药后2小时疼痛缓解、2-48小时持续无疼痛、24小时内使用挽救药物以及给药后2小时功能恢复正常的患者比例)方面均具有统计学意义的显著疗效(表3)。疼痛缓解定义为偏头痛从中度或重度严重程度减轻至轻度或无疼痛。给药后2小时功能恢复正常的患者比例来自于单项问卷,要求患者在4分量表上选择一个选项:功能正常、轻度损害、重度损害或需要卧床休息。
表3. 研究1和研究2中偏头痛急性治疗的关键次要疗效终点
| 研究1# | 研究2# | |||
|---|---|---|---|---|
| 给药后2小时疼痛缓解 | ||||
| 给药后2-48小时内持续无疼痛 | ||||
| 给药后24小时内挽救药物的使用** | ||||
| 给药后2小时功能恢复正常的患者比例 | ||||
| 瑞美吉泮口崩片 75mg | 安慰剂 | 瑞美吉泮口崩片 75mg | 安慰剂 | |
| n/N* | 397/669 | 295/682 | 443/666 | 327/674 |
| 应答率(%) | 59.3 | 43.3 | 66.5 | 48.5 |
| 与安慰剂相比的差值(%) | 16.1 | 18.1 | ||
| p 值 | <0.0001a | <0.0001a | ||
| n/N* | 90/669 | 37/682 | 99/666 | 48/674 |
| 应答率(%) | 13.5 | 5.4 | 14.9 | 7.1 |
| 与安慰剂相比的差值(%) | 8.0 | 7.7 | ||
| p 值 | <0.0001a | <0.0001a | ||
| n/N* | 95/669 | 199/682 | 56/666 | 135/674 |
| 应答率(%) | 14.2 | 29.2 | 8.4 | 20.0 |
| 与安慰剂相比的差值(%) | -15.0 | -11.5 | ||
| p 值 | <0.0001a | <0.0001a | ||
| n/N* | 255/669 | 176/682 | 222/545 | 131/551 |
| 应答率(%) | 38.1 | 25.8 | 40.7 | 23.8 |
| 与安慰剂相比的差值(%) | 12.3 | 16.9 | ||
| p 值 | <0.0001a | <0.0001a | ||
*n = 应答者人数/N = 该治疗组的患者人数
**该分析仅包括给药后24小时内使用NSAIDs,对乙酰氨基酚,或止吐药;不允许使用曲坦类或其他治疗急性偏头痛的药物
a 具有统计学显著意义的p 值
# 研究1:美国研究(NCT03461757);研究2:亚洲研究(中国+韩国,NCT04574362)
药理作用
硫酸瑞美吉泮是一种降钙素基因相关肽(CGRP)受体拮抗剂。
毒理研究
遗传毒性
硫酸瑞美吉泮Ames试验、体外中国仓鼠卵巢(CHO)细胞染色体畸变试验、大鼠体内骨髓微核试验结果均为阴性。
生殖毒性
雄性和雌性大鼠在交配前和交配期间,雌性大鼠持续给药至妊娠期第7天经口给予硫酸瑞美吉泮30、60、150mg/kg/天,高剂量可导致生育力降低。降低剂量进行第二项试验,给药剂量为5、15、25mg/kg/天,未见对生育力和早期胚胎发育的不良影响。大鼠生育力和早期胚胎发育毒性无影响剂量(60mg/kg/天)下的血浆暴露量约为人最大推荐剂量(MRHD)75mg/天暴露量的30倍。
妊娠大鼠于器官发生期经口给予硫酸瑞美吉泮10、60、300mg/kg/天,高剂量可导致与母体毒性相关的胎仔体重降低和胎仔骨骼变异发生率增加。大鼠胚胎发育毒性无影响剂量(60 mg/kg)下的血浆暴露量约为人MRHD暴露量的45倍。
妊娠兔于器官发生期经口给予硫酸瑞美吉泮10、25、50mg/kg/天,未见对兔胚胎发育的不良影响,高剂量(50mg/kg/天)下兔血浆暴露量约为人MRHD暴露量的10倍。
大鼠于妊娠期和哺乳期经口给予硫酸瑞美吉泮10、25、60mg/kg/天,对大鼠围产期发育未见影响,高剂量(60mg/kg/天)下大鼠血浆暴露量约为人MRHD暴露量的24倍。
致癌性
Tg.rasH2小鼠连续26周经口给予硫酸瑞美吉泮10、100、300mg/kg/天,大鼠连续91~100周经口给予硫酸瑞美吉泮5、20、45mg/kg/天,均未见药物诱导的肿瘤。大鼠高剂量(45mg/kg/天)下血浆暴露量约为人MRHD暴露量的30倍。
不超过30 °C 保存。
聚氯乙烯/聚酰胺/铝/聚酰胺/聚氯乙烯冷冲压成型固体药用复合硬片,并用可剥离铝箔密封。2片/盒,8片/盒。
48个月。
JX20230152
国药准字 HJ20240004
名 称:Pfizer Inc.
注册地址:66 Hudson Boulevard East, New York, NY 10001 United States of America
企业名称:Catalent Pharma Solutions Limited
生产地址:Frankland Road, Blagrove, Swindon, Wiltshire SN5 8RU UNITED KINGDOM
包装企业(次级包装厂)名称:Pfizer Ireland Pharmaceuticals Unlimited Company
包装地址:Little Connell, Newbridge, W12 HX57, Ireland
名 称:辉瑞投资有限公司
地 址:上海市南京西路1168 号中信泰富广场36 层
联系方式:400 910 0055
2024年01月23日
2025年05月01日;2025年07月01日